题目内容
(2012?房山区一模)有关金属钠、镁在氯气(Cl2)和二氧化碳中燃烧的化学方程式如下:
①2Na+Cl2
2NaCl;
②2Mg+CO2
2MgO+C.
由此获得的认识中,说法错误的是( )
①2Na+Cl2
| ||
②2Mg+CO2
| ||
由此获得的认识中,说法错误的是( )
分析:A、根据置换反应的定义进行分析回答;
B、氧元素的化合价没有变化;
C、凡是剧烈的发光发热的反应都可以叫做燃烧;
D、镁的燃烧不可以用二氧化碳灭火;
B、氧元素的化合价没有变化;
C、凡是剧烈的发光发热的反应都可以叫做燃烧;
D、镁的燃烧不可以用二氧化碳灭火;
解答:解:A、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,②反应符合化合反应的定义,故A说法正确;
B、在②中氧元素的化合价在反应前后没有变化,仍旧是-2价,故B说法错误;
C、凡是剧烈的发光发热的反应都可以叫做燃烧,故C说法正确;
D、能与二氧化碳反应的物质燃烧后不能用二氧化碳灭火,如镁,故D说法正确;
故选B
B、在②中氧元素的化合价在反应前后没有变化,仍旧是-2价,故B说法错误;
C、凡是剧烈的发光发热的反应都可以叫做燃烧,故C说法正确;
D、能与二氧化碳反应的物质燃烧后不能用二氧化碳灭火,如镁,故D说法正确;
故选B
点评:本题考查了置换反应的定义、燃烧的概念、元素化合价在反应前后的变化,考查全面.

练习册系列答案
相关题目
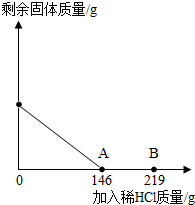 (2012?房山区一模)在一烧杯中盛有42.2g碳酸钙和氯化钙的粉末状混合物,向其中加入116.6g水,使氯化钙完全溶解.然后向其中逐滴加入10%的稀盐酸,烧杯中剩余固体的质量与加入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
(2012?房山区一模)在一烧杯中盛有42.2g碳酸钙和氯化钙的粉末状混合物,向其中加入116.6g水,使氯化钙完全溶解.然后向其中逐滴加入10%的稀盐酸,烧杯中剩余固体的质量与加入稀盐酸的质量关系曲线如图所示,请根据题意回答问题: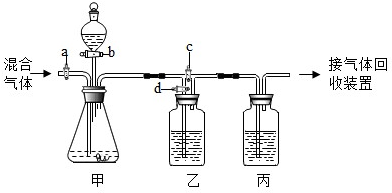 (2012?房山区一模)用如图的装置将一定量的CO2和CO的混合气体进行分离和干燥.图中的a、b、c、d均为活塞,可以控制气体的通过和液体的加入,实验前活塞均已关闭.请选择适宜的试剂完成上述实验.供选用的试剂有:①稀硫酸②浓硫酸③氢氧化钠溶液④澄清的石灰水(试剂均足量)
(2012?房山区一模)用如图的装置将一定量的CO2和CO的混合气体进行分离和干燥.图中的a、b、c、d均为活塞,可以控制气体的通过和液体的加入,实验前活塞均已关闭.请选择适宜的试剂完成上述实验.供选用的试剂有:①稀硫酸②浓硫酸③氢氧化钠溶液④澄清的石灰水(试剂均足量) (2012?房山区一模)“过氧化钠(Na2O2)”是一种淡黄色固体,能与水或二氧化碳反应放出氧气.实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分及其质量.
(2012?房山区一模)“过氧化钠(Na2O2)”是一种淡黄色固体,能与水或二氧化碳反应放出氧气.实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分及其质量.