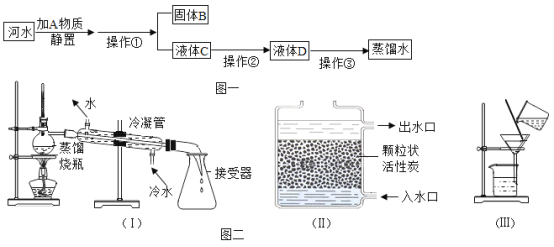
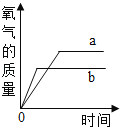
题目内容
【题目】实验室常用溶质质量分数为98%的浓硫酸(密度1.84g/cm3)来配制需要用的较稀的硫酸溶液。现要配制500mL溶质质量分数为20%(密度为1.14g/cm3)的稀硫酸溶液,需要多少毫升浓硫酸?_________________________需要加水多少毫升?______________
【答案】63.22mL 453.67mL
【解析】
解:设浓硫酸的质量为m1质量分数为w1,稀硫酸质量为m2,质量分为w2。
500mL的稀硫酸质量为:500mL×1.14g/![]() 570g,
570g,
浓硫酸加水稀释后,溶质质量不变,则m1×w1=m2×w2,带入数据得:m1×98%=570g×20%,
解之得:m1≈116.33g,则需要浓硫酸的体积为:v=![]() ;
;
需要加水的质量为:570g-116.33g=453.67g。
则加入水的体积为:v=![]()

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
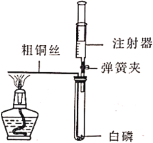
【题目】为探究催化剂对双氧水(H2O2)分解的催化效果,某研究小组做了如下实验:
实验一:
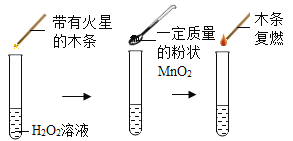
实验二:数据记录表
1%H2O2溶液(mL) | 50 | 50 | 50 |
加入MnO2的质量(g) | 0.1 | 0.2 | 0.4 |
测量40秒末得到O2体积(mL) |
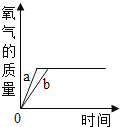
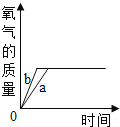
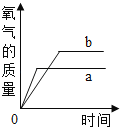
(实验一):图中的实验_____(填“能”或(不能))证明二氧化锰(MnO2)是过氧化氢分解反应的催化剂?理由_____。
(实验二):从表格的设计可以看出,该实验的目的是_____。所得氧气的体积分数越大,说明反应速率越_____(填“快”或“慢”)。