题目内容
【题目】某兴趣小组为测定一包石灰石样品中碳酸钙的质量分数,进行实验:往12克的固体样品中不断加入稀盐酸,直到没有气泡产生,共用去稀盐酸100克。测得相关数据如图所示: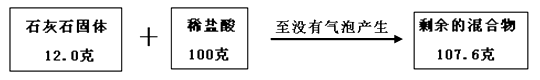
注:①该反应中,样品中的杂质不参加反应,碳酸钙完全反应。
②计算结果保留一位小数。
(1)根据质量守恒定律,反应生成二氧化碳的质量为g.
(2)计算该样品中碳酸钙的质量分数.(写出计算过程)
【答案】
(1)4.4g
(2)解:根据质量守恒定律,反应前后物质的总质量不变,生成二氧化碳的质量为100g+12.0g107.6g=4.4g;设样品中碳酸钙的质量为x,则
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 44 | ||
x | 4.4g |
100/x=44/4.4g x=10g
样品中碳酸钙的含量为10g÷12.0g×100%≈83.3%
答:该样品中碳酸钙的质量分数为83.3%
【解析】根据质量守恒定律即可算出二氧化碳的质量,再根据二氧化碳的质量即可算碳酸钙的质量。
故答案为:解:根据质量守恒定律,反应前后物质的总质量不变,生成二氧化碳的质量为100g+12.0g107.6g=4.4g;
设样品中碳酸钙的质量为x,则
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 44 | ||
x | 4.4g |
100/x=44/4.4g x=10g
样品中碳酸钙的含量为10g÷12.0g×100%≈83.3%
答:该样品中碳酸钙的质量分数为83.3%
本题主要考察质量守恒定律和依据化学方程式的计算。在化学反应中,参加反应的物质质量等于新生产的物质质量,而且各物质质量之比等于相对分子质量乘以化学计量数之比。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目

