题目内容
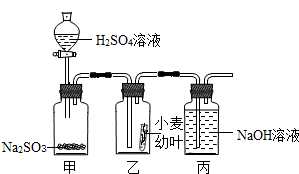 针对市场上一些不法商贩使用有毒的SO2气体对某些食品进行漂白,某科技兴趣小组以小麦幼叶为实验对象,研究SO2对植物的危害.他们通过查阅资料,得知硫酸溶液与固态的亚硫酸钠反应可产生SO2气体,设计实验如图所示.
针对市场上一些不法商贩使用有毒的SO2气体对某些食品进行漂白,某科技兴趣小组以小麦幼叶为实验对象,研究SO2对植物的危害.他们通过查阅资料,得知硫酸溶液与固态的亚硫酸钠反应可产生SO2气体,设计实验如图所示.
(1)该小组从实验室取得溶质质量分数为75%硫酸溶液100克,含硫酸多少克?
(2)该小组若想制取0.64克二氧化硫,至少需要亚硫酸钠多少克?
(化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O)
(3)在实验中,丙装置的作用是________;
(4)其他实验条件相同情况下,该小组观察到小麦幼叶在不同光照强度下,叶片发生变化时间不同,如下表所示.
| 室内 | 阳光下 | ||
| 出现烟斑时间 | 叶片变黄时间 | 出现烟斑时间 | 叶片变黄时间 |
| 30分钟 | 38分钟 | 15分钟 | 23分钟 |
(1)解:含硫酸的质量为
100g×75%=75g
答:含硫酸75g.
(2)解:设需要亚硫酸钠的质量为x.
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
126 64
x 0.64g
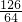 =
=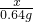 ,x=1.26g
,x=1.26g
答:需要亚硫酸钠1.26g.
(3)丙装置中的氢氧化钠溶液能与二氧化硫反应生成亚硫酸钠,防止了二氧化硫排放到空气中,防止了空气污染.
故答案为:吸收二氧化硫,防止空气污染.
(4)由表中数据看出:光照的强弱会影响叶表皮气孔的开放程度,进而导致二氧化硫对植物的危害随光照的加强而增大.
故答案为:光照的强弱会影响叶表皮气孔的开放程度,进而导致二氧化硫对植物的危害随光照的加强而增大.
分析:(1)由溶液质量和溶质质量分数根据溶质质量分数的计算公式可以计算出溶质质量.
(2)由生成二氧化硫的质量根据化学方程式可以计算出参加反应的亚硫酸钠的质量.
(3)若没有丙装置,二氧化硫就会释放到空气中,会污染空气.
(4)由表中数据可以看出:光照加强,二氧化硫对植物的危害增大.
点评:本题考查溶质质量分数的计算、有关化学方程式的计算、碱的化学性质、实验探究二氧化硫的危害等知识,难度稍大.
100g×75%=75g
答:含硫酸75g.
(2)解:设需要亚硫酸钠的质量为x.
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
126 64
x 0.64g
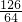 =
=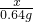 ,x=1.26g
,x=1.26g答:需要亚硫酸钠1.26g.
(3)丙装置中的氢氧化钠溶液能与二氧化硫反应生成亚硫酸钠,防止了二氧化硫排放到空气中,防止了空气污染.
故答案为:吸收二氧化硫,防止空气污染.
(4)由表中数据看出:光照的强弱会影响叶表皮气孔的开放程度,进而导致二氧化硫对植物的危害随光照的加强而增大.
故答案为:光照的强弱会影响叶表皮气孔的开放程度,进而导致二氧化硫对植物的危害随光照的加强而增大.
分析:(1)由溶液质量和溶质质量分数根据溶质质量分数的计算公式可以计算出溶质质量.
(2)由生成二氧化硫的质量根据化学方程式可以计算出参加反应的亚硫酸钠的质量.
(3)若没有丙装置,二氧化硫就会释放到空气中,会污染空气.
(4)由表中数据可以看出:光照加强,二氧化硫对植物的危害增大.
点评:本题考查溶质质量分数的计算、有关化学方程式的计算、碱的化学性质、实验探究二氧化硫的危害等知识,难度稍大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
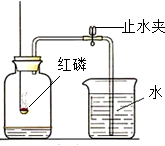 已知空气中的主要成分是氮气和氧气.某课外活动小组设计了如图所示的测定空气中氧气的含量的实验:在燃烧匙内盛过量的红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,待红磷火焰熄灭、集气瓶冷却至室温后,再打开止水夹.请回答下列问题:
已知空气中的主要成分是氮气和氧气.某课外活动小组设计了如图所示的测定空气中氧气的含量的实验:在燃烧匙内盛过量的红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,待红磷火焰熄灭、集气瓶冷却至室温后,再打开止水夹.请回答下列问题: