题目内容
(2012?呼和浩特)海洋中有丰富的资源,如图所示利用海水可获得许多化工产品.
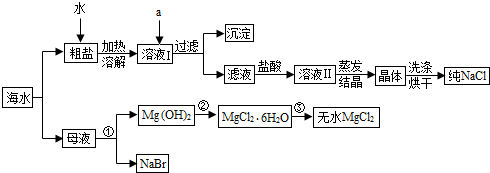
(1)粗盐中除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液中选出a所代表的试剂,按滴加顺序依次为:
(2)在滤液中加盐酸的作用是
(3)第③步发生的基本反应类型是

(1)粗盐中除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液中选出a所代表的试剂,按滴加顺序依次为:
过量的NaOH溶液
过量的NaOH溶液
、过量的BaCl2溶液、过量的Na2CO3溶液
过量的Na2CO3溶液
.加入BaCl2溶液发生反应的化学方程式为BaCl2+Na2SO4═BaSO4↓+2NaCl
BaCl2+Na2SO4═BaSO4↓+2NaCl
.(2)在滤液中加盐酸的作用是
除去溶液中的NaOH、Na2CO3
除去溶液中的NaOH、Na2CO3
.(3)第③步发生的基本反应类型是
分解
分解
反应.分析:(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,则用氢氧化钠除掉氯化镁,用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡;
(2)根据(1)中加的试剂都是过量分析;
(3)根据反应物、生成物判断反应类型;
(2)根据(1)中加的试剂都是过量分析;
(3)根据反应物、生成物判断反应类型;
解答:解:(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,则用氢氧化钠除掉氯化镁,用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡,则从提供的试剂中选出a所代表的试剂,按正确滴加顺序依次为:过量的NaOH溶液、过量氯化钡溶液、过量碳酸钠溶液;氯化钡和硫酸钠反应生成硫酸钡和氯化钠,反应的化学方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl;故填:过量的NaOH溶液;过量碳酸钠溶液;BaCl2+Na2SO4═BaSO4↓+2NaCl;
(2)在滤液中加盐酸的作用,在滤液中加盐酸的作用是除去NaOH、Na2CO3溶液;故填:除去溶液中的NaOH、Na2CO3;
(3)带结晶水的氯化镁加热生成氯化镁和水,“一变多”是分解反应,故填:分解;
(2)在滤液中加盐酸的作用,在滤液中加盐酸的作用是除去NaOH、Na2CO3溶液;故填:除去溶液中的NaOH、Na2CO3;
(3)带结晶水的氯化镁加热生成氯化镁和水,“一变多”是分解反应,故填:分解;
点评:掌握氯化钠与粗盐的提纯的方法及其注意事项;掌握一定溶质质量分数的溶液的配制方法;了解除杂和净化的方法.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目