题目内容
【题目】某元素的化合价为+3,其氧化物的相对分子质量为102,则该元素的相对原子质量为( )
A.40
B.56
C.27
D.24
【答案】C
【解析】解:设该元素为R元素,该元素的化合价为+3价,氧元素显﹣2价,其氧化物的化学式为R2O3 , 设该元素的相对原子质量为x,该元素氧化物的相对分子质量为x×2+16×3=102.x=27
故选C.

练习册系列答案
相关题目
【题目】镁条在空气中久置表面会变黑,某小组同学设计并进行实验,探究镁条变黑的条件.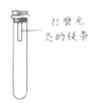
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应.
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关
【进行实验】通过控制与镁条接触的物质,利用如图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天.
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mLNaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸再通入约4mLCO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水再通入约4mLCO2 | 镁条第3天开始变黑至第20天全部变黑 |
(1)【解释与结论】
实验1和2中,NaOH浓溶液的作用是(用化学方程式表示).
(2)实验1的目的是 .
(3)实验3中,试管内的气体主要含有CO2、 .
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是(填编号).
(5)由上述实验可推知,镁条变黑的条件是 .
(6)【反思与评价】
在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是 .
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是 .



