题目内容
【题目】为测定某一批次盐酸的溶质质量分数,取其中一瓶和一定量的锌粒进行了如下实验(不计每步损耗)。
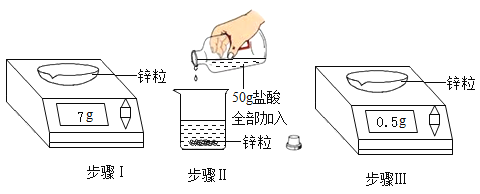
步骤 I :称取一定质量锌粒7g。
步骤 II:将 I 称量所得锌粒转移至烧杯中,加入该50g盐酸充分反应。
步骤 III:将 II 中反应后的混合物过滤,对剩余锌粒烘干、冷却再称量0.5g。
①参加反应的锌粒的质量是___________________,物质的量为___________________mol。
②该盐酸溶质质量分数(根据化学方程式列式计算)___________________
【答案】6.5g 0.1 14.6%
【解析】
解:①参加反应的锌粒的质量是7g-0.5g=6.5g;参加反应锌的物质的量=![]() ;
;
②设:盐酸中HCl的物质的量为x
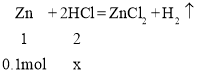
![]()
x=0.2mol
盐酸中HCl的质量为:![]() 克
克
盐酸的溶质质量分数为:![]()
答:盐酸的溶质质量分数为14.6%。

练习册系列答案
相关题目