题目内容
九年级化学兴趣小组在研究假黄金成份时,称取10.0g假黄金(铜锌合金)置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去93.7g稀硫酸,反应后烧杯内剩余物质的质量是103.5g.
(1)该假黄金中锌的质量分数为多少?
(2)反应后所得溶液中溶质的质量分数是多少?
(1)该假黄金中锌的质量分数为多少?
(2)反应后所得溶液中溶质的质量分数是多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:锌与稀硫酸反应生成硫酸锌,同时放出氢气;根据质量守恒定律,实验前后烧杯中物质的质量差即为反应放出氢气的质量;而利用锌和稀硫酸反应的方程式依据氢气的质量可以求出生成的硫酸锌和反应的锌的质量,即可求出反应后溶液的溶质质量分数.
解答:解:生成氢气的质量为10g+93.7gg-103.5g=0.2g;
设样品中锌和生成的硫酸锌的质量分别是x、y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
=
=
x=6.5g y=16.1g
(1)假黄金中锌的质量分数为:
×100%=65%;
答:假黄金中锌的质量分数为65%;
(2)杂质的质量是10g-6.5g=3.5g 溶液的质量是103.5g-3.5g=100g
反应后所得溶液中溶质的质量分数为:
×100%=16.1%.
答:反应后所得溶液中溶质的质量分数为16.1%.
设样品中锌和生成的硫酸锌的质量分别是x、y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
| 65 |
| x |
| 161 |
| y |
| 2 |
| 0.2g |
x=6.5g y=16.1g
(1)假黄金中锌的质量分数为:
| 6.5g |
| 10g |
答:假黄金中锌的质量分数为65%;
(2)杂质的质量是10g-6.5g=3.5g 溶液的质量是103.5g-3.5g=100g
反应后所得溶液中溶质的质量分数为:
| 16.1g |
| 100g |
答:反应后所得溶液中溶质的质量分数为16.1%.
点评:本题主要考查了学生解决有关含杂质物质的化学方程式的计算能力,解题关键是根据质量守恒定律首先求出氢气的质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法不正确的是( )
| A、夜间发现家中天然气泄漏,立即开灯查明泄漏原因 |
| B、因为铁在潮湿的环境中容易生锈,所以花盆不宜用铁制品 |
| C、手机是通过对电磁波的接收与发射来完成通话的 |
| D、“B”超是利用超声波来工作的 |
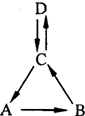 A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略
A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略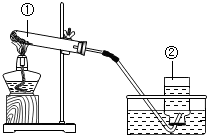 实验室采用如图装置加热高锰酸钾来制取氧气.
实验室采用如图装置加热高锰酸钾来制取氧气.
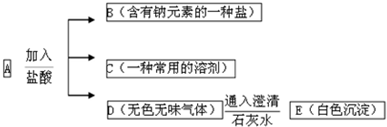
 写出如图转化的化学方程式:
写出如图转化的化学方程式: