题目内容
【题目】我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其模拟流程如下:
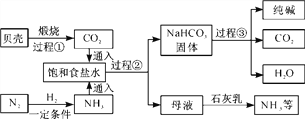
【小资料】
Ⅰ.贝壳的主要成分是CaCO3。
Ⅱ.通常情况下,1体积水中大约能溶解700体积氨气,1体积水中大约能溶解1体积二氧化碳。
Ⅲ.饱和食盐水中发生的主要反应为:NH3+CO2+H2O===NH4HCO3,NH4HCO3+NaCl===NaHCO3↓+NH4Cl。
(1)过程②中主要操作的名称是________。
(2)过程①中发生反应的化学方程式为________________________________,过程③中反应所属基本反应类型为____________。
(3)为了提高产率,往饱和食盐水中通入气体时,你认为应该先通入________(填“NH3”或“CO2”),你的理由是________________________________________________________________。
(4)上述流程中可以循环利用的物质是________(填化学式)。
【答案】 过滤 CaCO3![]() CaO+CO2↑ 分解反应 NH3 氨气在水中的溶解度大,先通氨气会吸收更多的二氧化碳,有利于生成较多的碳酸氢钠 CO2
CaO+CO2↑ 分解反应 NH3 氨气在水中的溶解度大,先通氨气会吸收更多的二氧化碳,有利于生成较多的碳酸氢钠 CO2
【解析】(1)操作②是将碳酸氢钠固体与氯化铵溶液分离,故操作②的名称是过滤;(2)反应①的化学方程式为:CaCO3![]() CaO+CO2↑;反应③中,碳酸氢钠分解生成碳酸钠、水和二氧化碳,属于分解反应;(3)往饱和食盐水中通入气体时,应该先通入氨气,因为氨气在水中的溶解度大,先通氨气会吸收更多的二氧化碳,有利于生成较多的碳酸氢钠,故填:因为氨气在水中的溶解度大,先通氨气会吸收更多的二氧化碳,有利于生成较多的碳酸氢钠;(4)从反应过程看出将二氧化碳通过氨盐水制取碳酸氢钠和氯化铵,碳酸氢钠分解生成二氧化碳,所以二氧化碳可循环利用。
CaO+CO2↑;反应③中,碳酸氢钠分解生成碳酸钠、水和二氧化碳,属于分解反应;(3)往饱和食盐水中通入气体时,应该先通入氨气,因为氨气在水中的溶解度大,先通氨气会吸收更多的二氧化碳,有利于生成较多的碳酸氢钠,故填:因为氨气在水中的溶解度大,先通氨气会吸收更多的二氧化碳,有利于生成较多的碳酸氢钠;(4)从反应过程看出将二氧化碳通过氨盐水制取碳酸氢钠和氯化铵,碳酸氢钠分解生成二氧化碳,所以二氧化碳可循环利用。

