题目内容
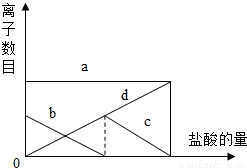
 向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
- A.a:Cl-; b:K+; c:CO32-; d:HCO3-
- B.a:K+; b:CO32-; c:Cl-; d:HCO3-
- C.a:K+; b:CO32-; c:HCO3-;d:Cl-
- D.a:K+; b:HCO3-; c:Cl-; d:CO32-;
C
分析:因考虑K2CO3在溶液中电离出K+和CO32-,盐酸溶液中存在H+、Cl-,因而出现CO32-+H+═HCO3-,然后HCO3-+H+═H2O+CO2↑,因而向一定量的K2CO3溶液中缓慢地滴加稀盐酸,即出现如图现象.
解答:由于Cl-没有发生反应生成气体、沉淀、水,所以随着稀盐酸的加入,Cl-的数目正比例上升,是曲线d;K+也不反应,且始终在溶液中的数目不变,是曲线a;
又因为开始CO32-+H+═HCO3-,所以CO32-的数目减少,是曲线b,HCO3-的数目增加,后来HCO3-+H+═H2O+CO2↑,所以HCO3-的数目又减少,是曲线c,所以四条曲线与溶液中的离子的对应关系完全正确的是C.
故选 C
点评:此题既考查学生对酸的性质理解运用,又渗透离子反应的实质,还锻炼学生的良好推断能力.难度较大.
分析:因考虑K2CO3在溶液中电离出K+和CO32-,盐酸溶液中存在H+、Cl-,因而出现CO32-+H+═HCO3-,然后HCO3-+H+═H2O+CO2↑,因而向一定量的K2CO3溶液中缓慢地滴加稀盐酸,即出现如图现象.
解答:由于Cl-没有发生反应生成气体、沉淀、水,所以随着稀盐酸的加入,Cl-的数目正比例上升,是曲线d;K+也不反应,且始终在溶液中的数目不变,是曲线a;
又因为开始CO32-+H+═HCO3-,所以CO32-的数目减少,是曲线b,HCO3-的数目增加,后来HCO3-+H+═H2O+CO2↑,所以HCO3-的数目又减少,是曲线c,所以四条曲线与溶液中的离子的对应关系完全正确的是C.
故选 C
点评:此题既考查学生对酸的性质理解运用,又渗透离子反应的实质,还锻炼学生的良好推断能力.难度较大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
 20、向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )
20、向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( ) (2011?南开区一模)向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )
(2011?南开区一模)向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )