题目内容
【题目】四氧化三铁通常用作颜料和抛光剂,也可用于制造录音磁带和电讯器材。以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,其他成分不考虑)为原料,生产四氧化三铁的工艺流程如下:
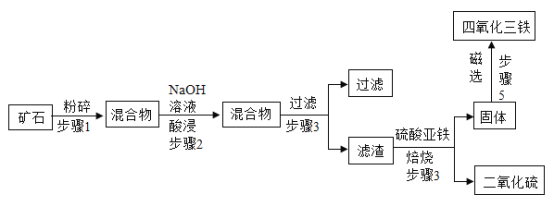
(资料: Al2O3、SiO2与NaOH溶液反应生成溶于水的NaAlO2、Na2SiO3)
请回答下列问题:
(1)步骤1中矿石粉碎的目的是_________。
(2)步骤2中加入NaOH溶液,反应之一是2NaOH+ Al2O3=2NaAlO2+X,X是__。
(3)步骤3中得到的滤液溶质主要成分的化学式是______。
(4)步骤4中的滤渣中含有的大量Fe2O3与FeS2混合后在缺氧条件下高温焙烧发生反应,反应的化学方程式为_______________。
【答案】增大反应物的接触面积,加快反应速率,使反应更充分 H2O NaAlO2、Na2SiO3 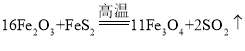
【解析】
(1)步骤1中矿石粉碎,可以增大反应物之间的接触面积,从而加快反应速度,使反应更充分。故答案为:增大反应物的接触面积,加快反应速率,使反应更充分;
(2)步骤2中,根据质量守恒定律可知,反应前后原子的个数相同。则反应前有2个钠原子、5个氧原子、2个氢原子、2个铝原子,反应后有2个钠原子、2个铝原子、4个氧原子。相差了1个氧原子、2个氢原子,则X是H2O。故答案为:H2O。
(3)根据资料:Al2O3、SiO2与NaOH溶液反应生成为溶于水的NaAlO2、Na2SiO3知,步骤3发生的反应是氧化铝和氢氧化钠反应生成偏铝酸钠、二氧化硅和氢氧化钠反应生成硅酸钠,则得到的滤液溶质主要成分化学式是NaAlO2、Na2SiO3。故答案为:NaAlO2、Na2SiO3。
(4)步骤4中的反应,通过题干可知,Fe2O3与FeS2在缺氧的条件下高温焙烧,通过图示可知,反应生成了二氧化硫气体和可以被磁选的四氧化三铁,则反应方程式为: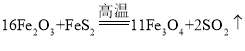 。故答案为:
。故答案为: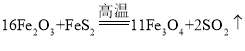 。
。