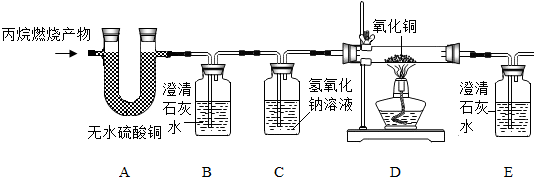
题目内容
(2008?西宁)为了测定某石化厂的废液中硫酸的含量,某兴趣小组进行了如下实验:取98g废液放入锥形瓶中,逐滴加10%的NaOH溶液(密度为1.1g/mL).36.4mL时,恰好完全反应.其反应方程式为:2NaOH+H2SO4═Na2SO4+2H2O(假设废液中其他成分不与氢氧化钠溶液反应)
求:
(1)36.4mL氢氧化钠溶液中溶质的质量;(结果保留1位小数)
(2)废液中硫酸的质量分数.
求:
(1)36.4mL氢氧化钠溶液中溶质的质量;(结果保留1位小数)
(2)废液中硫酸的质量分数.
分析:(1)根据密度公式结合氢氧化钠溶液的质量分数可以求算出氢氧化钠溶液中溶质的质量;
(2)根据氢氧化钠和硫酸反应的化学方程式可以求算出硫酸的质量,然后根据质量分数的计算公式求出硫酸的质量分数即可.
(2)根据氢氧化钠和硫酸反应的化学方程式可以求算出硫酸的质量,然后根据质量分数的计算公式求出硫酸的质量分数即可.
解答:解:(1)氢氧化钠溶液中溶质的质量为:36.4 mL×1.1 g/mL×10%=4.0 g
(2)解:设98g废液中H2SO4的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
4.0g x
=
解得:x=4.9g
废液中硫酸的质量分数为:
×100%=5%
答:(1)36.4mL氢氧化钠溶液中溶质的质量为4.0g;
(2)废液中硫酸的质量分数为5%.
(2)解:设98g废液中H2SO4的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
4.0g x
| 80 |
| 98 |
| 4.0g |
| x |
解得:x=4.9g
废液中硫酸的质量分数为:
| 4.9g |
| 98g |
答:(1)36.4mL氢氧化钠溶液中溶质的质量为4.0g;
(2)废液中硫酸的质量分数为5%.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识按照题目要求进行认真地选择或解答即可.

练习册系列答案
相关题目
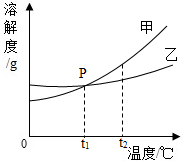 (2008?西宁)如图为甲、乙两种固体物质的溶解度曲线.
(2008?西宁)如图为甲、乙两种固体物质的溶解度曲线.