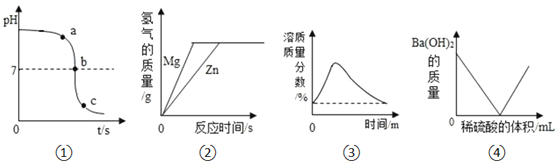
题目内容
【题目】随着生产的发展,家庭日化产品的种类也日益增多,如图所示是几种常见的家用清洁剂。
名称 | 84消毒液 | 洁厕灵 | 管道通 | 彩漂液 |
产品示例 |
|
|
|
|
有效成分 | 次氯酸钠(NaClO) | 盐酸(HCl) | 氢氧化钠(NaOH) | 过氧化氢(H2O2) |
(1)上述物质属于氧化物的是_____(写有效成分的物质名称或化学式)。
(2)“洁厕灵”与“84消毒液”不能混用,二者若混合其有效成分之间能发生化学反应,化学方程式为NaClO+2HCl=NaCl+H2O+X↑,则X的化学式为_____。
(3)“管道通”可使堵塞的管道畅通无阻,其管道疏通剂的有效成分为氢氧化钠,在使用时禁止与皮肤接触,其原因是_____;在使用时也不能与“洁厕灵”混合使用,其原因是_____。(用化学方程式表示)
【答案】过氧化氢; Cl2; 氢氧化钠具有强烈的腐蚀性; HCl+NaOH═NaCl+H2O。
【解析】
(1)过氧化氢(H2O2)是由钠元素和氧元素组成的化合物,属于氧化物;
(2)由质量守恒定律:反应前后,原子种类、数目均不变,则每个X分子由2个氯原子构成,则物质X的化学式为Cl2;
(3)管道疏通剂的有效成分为氢氧化钠,氢氧化钠具有强烈的腐蚀性,在使用时禁止与皮肤接触,氢氧化钠能与稀盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH═NaCl+H2O。

 口算能手系列答案
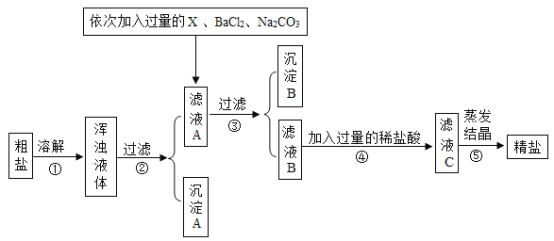
口算能手系列答案【题目】海水晒盐可制得粗盐,粗盐除氯化钠外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是某化学兴趣小组制定的一套制备精盐的实验方案,步骤如图所示:
(查阅资料)可溶性钡盐有剧毒,可以导致蛋白质变性,破坏体内一系列生理活动。
(1)步骤①中溶解粗盐时所加水的质量不宜过多,也不宜过少,过少会造成精盐的产率_____(填“偏高”或“偏低”)。沉淀B中共有_____种物质。
(2)符合试剂X要求的是_____(选填字母)。
A 碳酸钙
B 氢氧化钡溶液
C 氢氧化钠溶液
D 氢氧化钙溶液 E 氢氧化钾溶液
(3)甲乙同学为了证明滤液C是否有盐酸剩余,设计了下列实验方法进行实验探究。
(实验探究)
实验 | 实验操作 | 实验现象 | 实验结论 |
甲 | 取样,加入足量AgNO3溶液。 | _____ | 盐酸有剩余。写出盐酸发生反应的化学方程式_____。 |
乙 | 取样,加入适量的_____溶液。 | 有气泡逸出 | 盐酸有剩余。 |
丙同学认为甲的实验方案不严密,请说出理由_____。