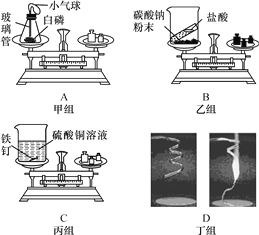
题目内容
【题目】用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如下图所示:
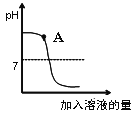
① 该实验是将 (填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
② A点溶液中的溶质为 。
③ 要测出反应过程中溶液的PH,应如何操作 。
【答案】稀盐酸 氢氧化钠和氯化钠 用洁净干燥的玻璃棒蘸取待测液少量滴在pH试纸的中间,半分钟后将试纸呈现的颜色与标准比色卡进行对照,从而确定溶液的pH。
【解析】
试题分析:刚开始溶液的pH大于7,所以是将稀盐酸加入氢氧化钠溶液中,A点时溶液呈碱性所以有氢氧化钠,又因为稀盐酸和氢氧化钠发生了反应生成氯化钠,所以此时溶质为氢氧化钠和氯化钠。测定溶液pH的操作为用洁净干燥的玻璃棒蘸取待测液少量滴在pH试纸的中间,半分钟后将试纸呈现的颜色与标准比色卡进行对照,从而确定溶液的pH。

【题目】研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】过氧化氢生成氧气的快慢与催化剂种类有关
【实验方案】常温下,在两瓶体积相同、浓度相同的过氧化氢溶液中分别加入相同质量的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间。
【进行实验】图示是他们进行实验的装置图,气体发生装置中A仪器的名称是:_________,此实验中B处宜采用的气体收集方法是_____________。

【实验记录】
实验编号 | 1 | 2 |
反应物 | 6% 过氧化氢 | 6% 过氧化氢 |
催化剂 | 1 g红砖粉 | 1 g 二氧化锰 |
时间 | 152 s | 35 s |
【结论】该探究过程得出的结论_____________________。
【反思】过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快。若要证明二氧化锰和红砖粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的___________和_________是否变。
过氧化氢生成氧气的快慢还与哪些因素有关?请你帮助他们继续探究。(只要求提出假设和实验方案)