题目内容
某中学化学兴趣小组的同学为了检测当地石灰石中碳酸钙的纯度,取6.0g该石灰石样品(杂质不参加反应)与19g稀盐酸混合,恰好完全反应,测得残留物质量为22.8g.试计算:
(1)生成二氧化碳的质量;
(2)6.0g样品中碳酸钙的质量.
(1)生成二氧化碳的质量;
(2)6.0g样品中碳酸钙的质量.
分析:(1)根据石灰石样品与盐酸反应时,只有二氧化碳是气体,根据质量守恒定律则利用反应前后固液混合物的质量差来计算二氧化碳的质量;
(2)根据碳酸钙与盐酸反应的化学方程式,将二氧化碳的质量代入即可计算碳酸钙的质量.
(2)根据碳酸钙与盐酸反应的化学方程式,将二氧化碳的质量代入即可计算碳酸钙的质量.
解答:解:(1)因石灰石样品与盐酸反应中只有二氧化碳是气体,
根据质量守恒定律可知,
二氧化碳的质量为6.0g+19g-22.8g=2.2g,
答:生成二氧化碳的质量为2.2g;
(2)设6.0g样品中碳酸钙的质量为x,
则CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 2.2g
=
,解得x=5.0g,
答:6.0g样品中碳酸钙的质量为5.0g.
根据质量守恒定律可知,
二氧化碳的质量为6.0g+19g-22.8g=2.2g,
答:生成二氧化碳的质量为2.2g;
(2)设6.0g样品中碳酸钙的质量为x,
则CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 2.2g
| 100 |
| x |
| 44 |
| 2.2g |
答:6.0g样品中碳酸钙的质量为5.0g.
点评:本题考查学生利用化学反应方程式的计算,利用质量守恒计算二氧化碳气体的质量是解答的关键,然后将二氧化碳的质量代入化学反应方程式计算即可.

练习册系列答案
相关题目
某中学化学兴趣小组的同学在查阅资料时发现金属氧化物A(固体)也能加快氯酸钾的分解速率即起催化作用,且A和二氧化锰的最佳催化温度均在500℃左右.于是对A和二氧化锰的催化性能进行了定量对照实验,实验时均以收满500mL氧气为准(其他可能影响实验的因素均已忽略).
表1 用MnO2作催化剂
表2用A作催化剂
请回答:
(1)上述实验中的待测数据应是 ;
(2)写出表2内所发生反应的化学方程式: .
(3)若选择下列部分装置通过组合来完成该实验,你觉得最佳装置组合是(填序号) ,各装置的正确连接顺序是(填接口字母,括号内容可以不填满也可以再加)a→ → →
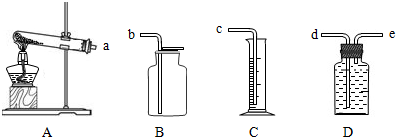
(4)如何判断已收集到500mL氧气 .
(5)完成此研究后,他们准备发表一篇小论文,请你替他们拟一个论文题目: .
表1 用MnO2作催化剂
| 实验序号 | KClO3质量/g | MnO2的质量/g | 反应温度/℃ | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
| 实验序号 | KClO3质量/g | A的质量/g | 反应温度/℃ | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
(1)上述实验中的待测数据应是
(2)写出表2内所发生反应的化学方程式:
(3)若选择下列部分装置通过组合来完成该实验,你觉得最佳装置组合是(填序号)

(4)如何判断已收集到500mL氧气
(5)完成此研究后,他们准备发表一篇小论文,请你替他们拟一个论文题目:
某中学化学兴趣小组的同学欲通过实验探究,验证精盐中杂质的种类和NaCl的含量。
探究一:这包粗盐中还有什么杂质?
提出问题:粗盐中可能含有较多的CaCl2
请你设计实验验证杂质的成分
| 操作步骤 | 实验现象 | 实验结论 |
探究二:这包粗盐中NaCl的质量分数是多少?
小凡同学按下面的步骤继续进行了实验,请你帮他补充完整。
①称取一定质量的样品(质量为W g)
②将样品加水溶解,制成粗盐溶液
③向粗盐溶液中加入过量的某种试剂,过滤
④沉淀洗涤后小心烘干,得到固体A
⑤向滤液中滴加适量的稀盐酸后,进行某一操作,即可得到纯净的固体B
⑥称量实验中得到的某种固体的质量
(1)在②③⑤的步骤中,都使用到的一种仪器是_________,它在步骤②和⑤中的操作方法相同。但目的不同,其目的分别是_____________,______________________。
(2)步骤⑤进行的“某一操作”是_________________,所需要的主要实验仪器有__________,加入稀盐酸的目的是___________________________。
(3)步骤⑥中,你认为需称量固体A还是固体B的质量____________,你不选择称量另一种固体的理由是:_______________________________。
