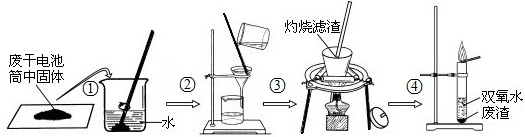
题目内容
 化学能转化为电能,在生产、生活中有重要的应用.
化学能转化为电能,在生产、生活中有重要的应用.I.氢氧燃料电池是符合绿色化学理念的新型电池.
右图是氢氧燃料电池的示意图,工作时H2和O2反应生
成水,同时提供电能,溶液的pH
小”或“不变”).
Ⅱ.某学校研究小组对废干电池筒内的黑色物质(可能含有C、MnO2、ZnCl2、NH4Cl等)进行研究,实验过程如下:
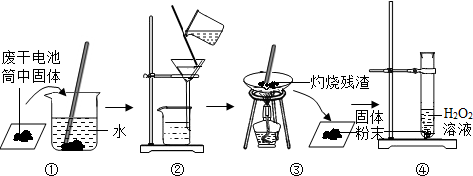
(1)操作②的名称是
(2)操作③中灼烧滤渣的化学反应方程式:
(3)操作④的试管中产生无色气体,该反应的化学方程式是
检验试管中所产生的气体的方法是
(4)ZnCl2和NH4Cl混合溶液中含有杂质CuCl2,会加速对电池的腐蚀,不利于混合溶液的回收使用.欲除去其中的Cu2+,最好选用下列试剂中的
a.NaOH b.Zn c.Fe d.Na2CO3.
分析:I.根据电池在工作时H2和O2反应生成水,有图可知对于KOH溶液的浓度变化来分析PH的变化;
Ⅱ.(1)根据题意可知是不溶性固体和液体的分离,并结合图②来解答;
(2)根据物质的溶解性来判断滤渣的成分,则可分析灼烧滤渣发生的化学反应;
(3)根据试管中的物质来推测发生的化学反应并利用物质的特性来检验常见的物质;
(4)根据除去杂质的原则可知既要除去杂质离子又要不能引入新的杂质离子来解答.
Ⅱ.(1)根据题意可知是不溶性固体和液体的分离,并结合图②来解答;
(2)根据物质的溶解性来判断滤渣的成分,则可分析灼烧滤渣发生的化学反应;
(3)根据试管中的物质来推测发生的化学反应并利用物质的特性来检验常见的物质;
(4)根据除去杂质的原则可知既要除去杂质离子又要不能引入新的杂质离子来解答.
解答:解:I.因电池在工作时H2和O2反应生成水,则使KOH溶液中溶剂变多,溶质不变,导致KOH溶液的浓度变小,即OH-的浓度也变小,所以溶液的PH变小,故答案为:变小;
Ⅱ.(1)因黑色物质中可能含有C、MnO2、ZnCl2、NH4Cl等成分,C、MnO2不溶于水,图②中有漏斗等仪器,则是过滤操作,在该操作中玻璃棒可引导液体流下,故答案为:过滤;引流;
(2)因C、MnO2不溶于水,则滤渣的成分为C、MnO2,灼烧时只有C能与氧气发生反应生成二氧化碳气体,故答案
为C+O2
CO2;
(3)由实验图可知,因C被灼烧转变为气体,则固体中只有二氧化锰,即图④中试管里的物质为二氧化锰和过氧化氢溶液,又过氧化氢可在二氧化锰作催化剂的条件下分解生成氧气,可利用氧气能使带火星的木条复燃来检验,故答案为:2H2O2
2H2O+O2↑;将带火星的木条放在试管中,木条复燃;
(4)ZnCl2和NH4Cl混合溶液中含有杂质CuCl2,除去其中的Cu2+,若用NaOH会和三种物质都反应,若用Fe会引入杂质亚铁离子,若用Na2CO3会使原物质发生反应的同时引入杂质离子钠离子,则只有固体Zn即除去杂质离子又不引入新的杂质离子,故答案为:b.
Ⅱ.(1)因黑色物质中可能含有C、MnO2、ZnCl2、NH4Cl等成分,C、MnO2不溶于水,图②中有漏斗等仪器,则是过滤操作,在该操作中玻璃棒可引导液体流下,故答案为:过滤;引流;
(2)因C、MnO2不溶于水,则滤渣的成分为C、MnO2,灼烧时只有C能与氧气发生反应生成二氧化碳气体,故答案
为C+O2
| ||
(3)由实验图可知,因C被灼烧转变为气体,则固体中只有二氧化锰,即图④中试管里的物质为二氧化锰和过氧化氢溶液,又过氧化氢可在二氧化锰作催化剂的条件下分解生成氧气,可利用氧气能使带火星的木条复燃来检验,故答案为:2H2O2
| ||
(4)ZnCl2和NH4Cl混合溶液中含有杂质CuCl2,除去其中的Cu2+,若用NaOH会和三种物质都反应,若用Fe会引入杂质亚铁离子,若用Na2CO3会使原物质发生反应的同时引入杂质离子钠离子,则只有固体Zn即除去杂质离子又不引入新的杂质离子,故答案为:b.
点评:本题利用化学反应与能量的关系来综合考查学生实验分析和解决问题的能力,具有较好的知识迁移应用并注重了化学的实用性.

练习册系列答案
相关题目
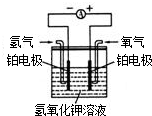 化学能转化为电能,在生产、生活中有重要的应用.
化学能转化为电能,在生产、生活中有重要的应用.