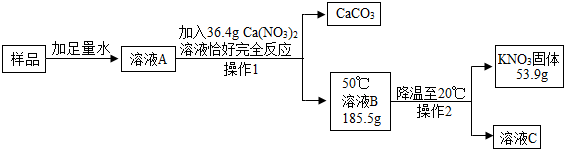
题目内容
溶液的应用非常广泛.K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
| 温度/℃ | 20 | 30 | 50 | 60 | 80 |
|
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 |
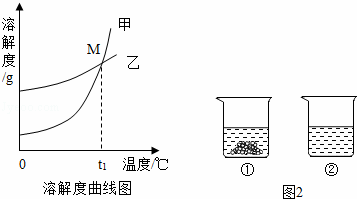
(1)硝酸钾溶液中的溶剂是 .
(2)图中能表示KNO3溶解度曲线的是 (填“甲”或“乙”).
(3)溶解度曲线上M点的含义是 .
(4)现有200g溶质质量分数为10%的碳酸钾溶液,若使溶液的溶质质量分数增加一倍,应该蒸发掉 g水.
(5)40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图2所示.下列有关说法中,正确的是 D (填字母序号).
A.烧杯②中溶液一定是不饱和溶液
B.若使烧杯①中固体全部溶解,溶液中溶质质量分数一定增大
C.将烧杯②中溶液降温至20℃时,溶液中溶质质量分数可能增大
D.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数可能增大.
| (1)根据溶剂、溶质的判断方法分析 (2)比较甲乙的溶解度变化趋势结合图中表格数据可以作出判断; (3)曲线中交点的含义表示两种物质的溶解度相等,可以据此解答; (4)根据溶质质量分数的计算方法考虑. (5)根据饱和溶液与不饱和溶液的转化方法分析 | |
| 解答: | 解:(1)硝酸钾溶液中溶质是硝酸钾,溶剂是水 (2)根据溶解度曲线可以知道,在温度较低时硝酸钾的溶解度较小,结合图中的两条溶解度曲线可以知道甲表示的是硝酸钾的溶解度曲线; (3)曲线中交点的含义表示两种物质的溶解度相等,所以M点的意义为:t1℃时,K2CO3和KNO3的溶解度相等; (4)根据溶质质量分数= 设蒸发掉水的质量为x,则20%= (5)A、由图示可知有不溶物的是硝酸钾,已经达到饱和,全部溶解的是碳酸钾溶液,全部溶解可能刚好饱和,也可能不饱和,所以A错误; B、使烧杯①中固体全部溶解,可以采用升高温度的方法,此时溶液中溶质质量分数不变,故B错误; C、将烧杯②中溶液降温至20℃时,可能析出晶体也可能没有,因此溶液中溶质质量分数不可能增大,故C错误; D、将烧杯①中的溶液变为不饱和溶液,可用加溶剂和升温的方法,若用升温方法,此时溶液中的溶质质量增大,溶质质量分数增大,故D正确; 故选D. 故答案为:(1)水.(2)甲.(3)t1°C时,碳酸钾和硝酸钾的溶解度相等.(4)100 (5)D |

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案 ×100%分析
×100%分析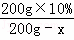 ×100% x=100g
×100% x=100g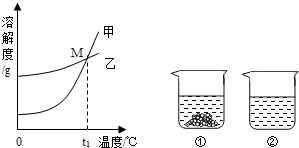
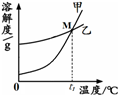 生产和生活中溶液的应用非常广泛.K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.
生产和生活中溶液的应用非常广泛.K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.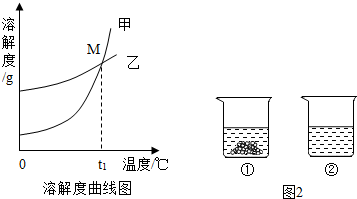
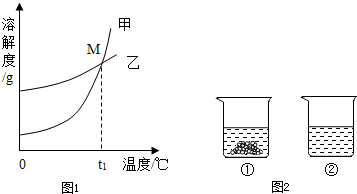
 (2013?高邮市二模)溶液的应用非常广泛.
(2013?高邮市二模)溶液的应用非常广泛.