题目内容
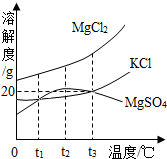
 如图是a、b、c三种物质的溶解度曲线.
如图是a、b、c三种物质的溶解度曲线.(1)P点表示
(2)t2℃时,将100g a物质加入到100g水中并充分搅拌,形成溶液的溶质质量分数为
(3)t2℃时,将a、b、c三种物质的饱和溶液降低温度到 t1℃时,这三种溶液中溶质质量分数的大小关系是
(4)a中含有少量的b,提纯a应采用的方法是
考点:固体溶解度曲线及其作用,结晶的原理、方法及其应用,溶质的质量分数、溶解性和溶解度的关系
专题:溶液、浊液与溶解度
分析:(1)根据P点表示t1℃时a、c的溶解度相同进行解答;
(2)根据t2℃时,a物质的溶解度为50g进行解答;
(3)根据温度对三种物质的溶解度的影响解答;
(4)根据a物质的溶解度受温度的影响变化较大进行解答.
(2)根据t2℃时,a物质的溶解度为50g进行解答;
(3)根据温度对三种物质的溶解度的影响解答;
(4)根据a物质的溶解度受温度的影响变化较大进行解答.
解答:解:(1)P点表示t1℃时a、c的溶解度相同;故填:t1℃时a、c的溶解度相同;
(2)t2℃时,a物质的溶解度为50g,所以t2℃时,将100ga物质加入到100g水中并充分搅拌,只能溶解50g,形成溶液的溶质质量分数=
×100%=33.3%;故填:33.3%;
(3)t2℃时,溶解度a>b>c,所以t2℃时a的饱和溶液溶质质量分数最多其次是b,最小的是c;t1℃时溶解度b>a=c,所以将t2℃时的abc三种物质的饱和溶液降低温度到t1℃,B的溶解度最大,ac的溶解度相等,但ab是饱和溶液,c是不饱和溶液,故溶质质量分数最大的是b其次是a最小的是c;故填:b>a>c;
(4)a物质的溶解度受温度的影响变化较大,所以a中含有少量的b,提纯a应采用的方法是降温结晶.故填:降温结晶.
(2)t2℃时,a物质的溶解度为50g,所以t2℃时,将100ga物质加入到100g水中并充分搅拌,只能溶解50g,形成溶液的溶质质量分数=
| 50g |
| 100g+50g |
(3)t2℃时,溶解度a>b>c,所以t2℃时a的饱和溶液溶质质量分数最多其次是b,最小的是c;t1℃时溶解度b>a=c,所以将t2℃时的abc三种物质的饱和溶液降低温度到t1℃,B的溶解度最大,ac的溶解度相等,但ab是饱和溶液,c是不饱和溶液,故溶质质量分数最大的是b其次是a最小的是c;故填:b>a>c;
(4)a物质的溶解度受温度的影响变化较大,所以a中含有少量的b,提纯a应采用的方法是降温结晶.故填:降温结晶.
点评:解答这类题目时,首先要熟记和理解固体溶解度曲线及其使用,固体溶解度的概念和意义,溶质质量分数及其有关计算,饱和溶液和不饱和溶液的概念及其相互转变方法,以及物质的溶解和结晶的方法等相关知识;

练习册系列答案
相关题目
 程伟同学将浑浊的湖水样品,倒人烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用下列装置进行过滤,回答下列问题:
程伟同学将浑浊的湖水样品,倒人烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用下列装置进行过滤,回答下列问题:
 海洋是地球上最大的储水库,蕴含着丰富的化学资源.海水晒盐能够得到粗盐和卤水.
海洋是地球上最大的储水库,蕴含着丰富的化学资源.海水晒盐能够得到粗盐和卤水.