题目内容
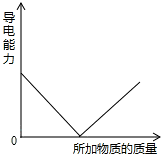
在稀硫酸中逐滴加入下列哪种物质,会使溶液的导电能力变化情况如图所示
- A.NaOH溶液
- B.Na2CO3溶液
- C.Ba(OH)2溶液
- D.BaCl2溶液
C
分析:水溶液要想导电必须具有自由移动的带电的微粒.带电的微粒越多越容易导电,再根据图示进行分析.由图示可知导电性越来越差,最后导电能力为零,也就是说恰好完全反应时没有自由移动的离子了,所加物质过量就又能够导电了.
解答:A、稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,硫酸钠能够电离出钠离子和硫酸根离子,所以能导电,故A错误;
B、稀硫酸与Na2CO3溶液反应生成硫酸钠、水、二氧化碳,硫酸钠能够电离出钠离子和硫酸根离子,所以能导电,故B错误;
C、稀硫酸与Ba(OH)2溶液反应生成硫酸钡沉淀和水,硫酸钡不能导电,水几乎不导电,所以恰好完全反应时,导电能力为零,再加氢氧化钡,氢氧化钡又能电离出钡离子和氢氧根离子,所以又能导电了,故C正确;
D、稀硫酸与氯化钡反应生成硫酸钡沉淀和盐酸,盐酸能电离出氢离子和氯离子,能导电,故D错误.
故选C.
点评:通过回答本题知道了两种物质反应后要想电离必须具有能自由移动的带电的微粒.
分析:水溶液要想导电必须具有自由移动的带电的微粒.带电的微粒越多越容易导电,再根据图示进行分析.由图示可知导电性越来越差,最后导电能力为零,也就是说恰好完全反应时没有自由移动的离子了,所加物质过量就又能够导电了.
解答:A、稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,硫酸钠能够电离出钠离子和硫酸根离子,所以能导电,故A错误;
B、稀硫酸与Na2CO3溶液反应生成硫酸钠、水、二氧化碳,硫酸钠能够电离出钠离子和硫酸根离子,所以能导电,故B错误;
C、稀硫酸与Ba(OH)2溶液反应生成硫酸钡沉淀和水,硫酸钡不能导电,水几乎不导电,所以恰好完全反应时,导电能力为零,再加氢氧化钡,氢氧化钡又能电离出钡离子和氢氧根离子,所以又能导电了,故C正确;
D、稀硫酸与氯化钡反应生成硫酸钡沉淀和盐酸,盐酸能电离出氢离子和氯离子,能导电,故D错误.
故选C.
点评:通过回答本题知道了两种物质反应后要想电离必须具有能自由移动的带电的微粒.

练习册系列答案
相关题目