题目内容
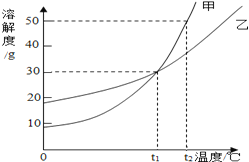
【题目】(6分)为测定某未知浓度的氢氧化钡溶液的溶质质量分数,取某稀硫酸溶液20 g,逐滴加入氢氧化钡溶液30 g,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示)。过滤后得滤液47.67 g。请你通过计算,求出氢氧化钡溶液的溶质质量分数。可能用到的相对原子质量:H—1 O—16 S—32 Ba—137

【答案】解:设参加反应的Ba(OH)2的质量为x
生成的BaSO4质量为:20 g+30 g-47.67 g=2.33 g……………………(1分)
Ba(OH)2+ H2SO4= BaSO4↓+2H2O …………………………………(1分)
171 233
x 2.33 g
![]() =
=![]() …………………………………………………………(2分)
…………………………………………………………(2分)
x=1.71 g ………………………………………………………………(1分)
Ba(OH)2的溶质质量分数=1.71 g÷25 g×100%=6.84% ………………(1分)
答:该溶液中Ba(OH)2的溶质质量分数为6.84%。
【解析】
本题考查的是根据化学反应方程式的计算,有关溶质质量分数的简单计算。解答本题关键是抓住反应前后溶液减轻的质量就是生成的沉淀硫酸钡的质量,然后结合图象得出加入的氢氧化钡质量为25g时,稀硫酸和氢氧化钡恰好完全反应,只要分析清楚这两点即可较快解答该题。
先根据质量守恒定律求出生成沉淀硫酸钡的质量,再根据化学方程式求出氢氧化钡的质量,然后根据溶质质量分数=![]() 求解。
求解。
根据质量守恒定律,生成BaSO4质量为20g+30g-47.67g=2.33g
设参加反应的Ba(OH)2的质量为X
Ba(OH)2+ H2SO4= BaSO4↓+2H2O
171 233
x 2.33 g
![]() =
=![]()
x=1.71 g
当加入的氢氧化钡质量为25g时,溶液的PH=7,酸碱恰好中和。说明,此时稀硫酸和氢氧化钡恰好完全反应,故Ba(OH)2的溶质质量分数=1.71 g÷25 g×100%=6.84%
答:该溶液中Ba(OH)2的溶质质量分数为6.84%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】资料显示,将新制的浓度为5%的过氧化氢溶液加热到80℃时才有较多的氧气产生。而向相同质量的5%的过氧化氢溶液加入二氧化锰,常温下就会立即产生氧气,因此实验室常使用此方法制氧气。
(1)实验室用过氧化氢制氧气的符号表达式为__________________________;
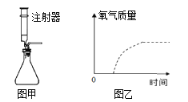
(2)利用图甲作为上述制取氧气的发生装置,注射器相当于___________(填一种仪器名称),它除添加液体试剂外,还具有的作用是__________________。
(3)分别采用两份质量相同且浓度均为5%的过氧化氢溶液制氧气,图乙虚线表示加热分解制取氧气的曲线,请在图中用实线画出加入二氧化锰制取氧气的曲线(假设两种情况下均完全分解)__________________。
(查阅资料)除二氧化锰外,某些物质可以作为过氧化氢溶液分解的催化剂。
(提出猜想)除二氧化锰外,氧化铜也可以作为过氧化氢溶液分解的催化剂。
(完成实验)按下表进行实验,实验数据记录如下:
实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
双氧水的质量和浓度 | 5g、5% | 5g、5% | 5g、5% |
加入的固体及质量 | 无 | MnO2 0.1g | CuO 0.1g |
相同时间内产生氧气的体积 | 3mL | 11mL | 9mL |
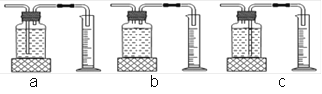
(4)本实验中,测量氧气体积的装置应选择________;
(数据分析)
(5)实验Ⅲ与实验______可知,氧化铜也可以加快过氧化氢分解的速率;
(6)通过比较___________________,发现二氧化锰比氧化铜的催化效果更好。
(讨论反思)
(7)为了最终确定氧化铜是否可以作为过氧化氢分解制氧气的催化剂,大家认为还需要补充完成两个实验:_____________________;___________________。