题目内容
【题目】同学们在实验室用5%的H2O2溶液制取氧气并进行氧气性质实验。
溶液配制:用50ml 30%的H2O2溶液制取氧气(密度为1.13g/cm3)配制5%的H2O2溶液(密度约为1g/cm3)。溶液配制过程中,除用到玻璃棒外还需用到下列仪器中的_____________。
A.托盘天平
B.烧杯
C.漏斗
D.量筒
E.胶头滴管
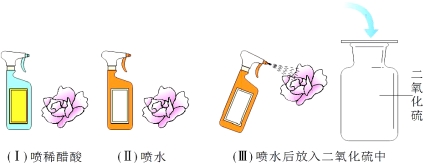
气体制备:用配制好的5%H2O2溶液和MnO2制取O2。请你在“A”、“B”两套装置中选择其中一套,并说明选择的理由_____________________,该反应的化学方程式为________________________。待反应结束后同学们回收了混合物中的MnO2,实验操作为____________________。

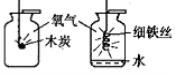
性质实验:小明用收集好的氧气,进行了下面的实验:
把点燃的木炭伸入集气瓶中,实验现象是_______________________;为使铁丝在氧气中持续剧烈燃烧,他把光亮的细铁丝盘成螺旋状,_____________________________________,缓慢插入集气瓶中,观察到持续剧烈燃烧。通过实验得出,氧气可以支持燃烧,并且可燃物燃烧更剧烈。
【答案】B、D、E A,
便于添加液体药品(或便于制得较多气体)【或B,装置简单(或节约药品)】(合理即可)
2H2O2![]() 2H2O+O2↑ 过滤、干燥
2H2O+O2↑ 过滤、干燥
发出白光,放出热量 下端系一根火柴,点燃火柴,待火柴快燃尽时
【解析】
试题分析:溶液配制分三个步骤:计算、称量、溶解,称量需要托盘天平、量筒、胶头滴管;溶解需要玻璃棒和烧杯;AB两套装置都可以用来制取氧气,A装置的优点在于可中途添加药品,B装置的优点在于装置简单;二氧化锰是不溶于水的固体,可用过滤实现分离;氧气有很强的氧化性,会使可燃物的燃烧变得更加旺盛。

【题目】小明发现二氧化锰催化过氧化氢分解的实验中,反应速度逐渐变慢。查阅资料得知:其原因是过氧化氢的溶质质量分数减小以及二氧化锰的催化能力降低。为了探究二氧化锰的催化能力降低的影响因素,进行如下实验。
【材料准备】取质量均为2克的二氧化锰分别催化40毫升溶质质量分数为10%、20%、30%的过氧化氢溶液分解,实验后回收二氧化锰,并分别标为A、B、C;另取多次催化分解10%过氧化氢溶液实验后回收的二氧化锰,标为D。
【实验步骤】
①连接装置并检查气密性。
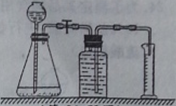
②取未使用过的二氧化锰0.5克,加入锥形瓶中,再加入10毫升溶质质量分数为5%的过氧化氢溶液,记录收集120毫升气体所需的时间。
③在分别取A、B、C、D组二氧化锰0.5克,重复上述实验。
④多次实验取平均值,记录数据如下:
组别 | 未使用过得二氧化锰 | A | B | C | D |
收集气体时间/秒 | 17.9 | 23.2 | 27.7 | 32.3 | 37.8 |
(1)实验时,长颈漏斗下端管口应在液面以下,其目的是 。
(2)实验中通过比较收集相同气体体积所需的时间外,还可以通过比较 来反映二氧化锰的催化能力。
(3)由上表数据可知,引起回收的二氧化锰的催化能力下降的因素是 。