题目内容
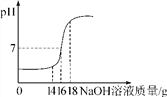
【题目】某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠固体。为测定氢氧化钠的变质情况,他们取9.3g变质的氢氧化钠样品于烧杯中,加人42.9 g水使其完全溶解,再向烧杯中滴加稀盐酸至过量。测得生成气体质量与所加稀盐酸质量关系如下图所示。

请计算:
(1)9.3g样品中碳酸钠的质量。
(2)B点时,烧杯内溶液的溶质质量分数。(计算结果精确至0.1%)
【答案】(1)5.3g;(2)11.7%
【解析】根据题意可知:已知量为二氧化碳的质量,未知量为碳酸钠的质量及B点时生成氯化钠的质量。可根据化学方程式中二氧化碳求出碳酸钠的质量与B点时生成氯化钠的质量。从而求出B点时烧杯内溶液的溶质质量分数。
解:(1)设样品中含碳酸钠的质量为x,与稀盐酸反应生成氯化钠的质量为y。
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 117 44
x y 2.2g
![]()
x=5.3g
y=5.85g
(2)B点时烧杯内溶液的质量为9.3g+42.9 g-2.2g=50g
B点时,烧杯内溶液的溶质质量分数为![]() =11.7%
=11.7%
答:9.3g样品中碳酸钠的质量为5.3g;B点时,烧杯内溶液的溶质质量分数为11.7%。

【题目】在实验过程中发现使用的镁条表面呈黑色。某兴趣小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】(1)镁条表面的黑色物质可能是碱式碳酸镁、带结晶水的碳酸镁以及氢氧化镁等。
(2)常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2和水蒸气有关。
【进行实验】取右图装置5个进行如下实验,并持续观察20天。

编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气 再加入2 mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2 mL 10%NaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2 mL浓硫酸 再通入约4 mL CO2 | 镁条始终无明显变化 |
4 | 先加入4 mL饱和Na2SO3溶液 再充满CO2 | 镁条第5天有极少量变黑 后来变黑面积没有增大 |
5 | 先加入2 mL蒸馏水 再通入约4 mL CO2 | 镁条第3天开始变黑 至第20天全部变黑 |
【解释与结论】
(1)实验1的目的是___________________________;
(2)实验4中,Na2SO3的作用是(用化学方程式表示)____________________________;
(3)通过两个实验__________(填编号)可得出镁条表面变黑一定与CO2有关;
(4)由上述实验可推知,镁条变黑的条件是____________________________。
【反思与评价】
(5)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是______________。