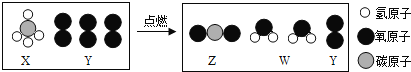
题目内容
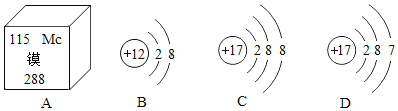
【题目】元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
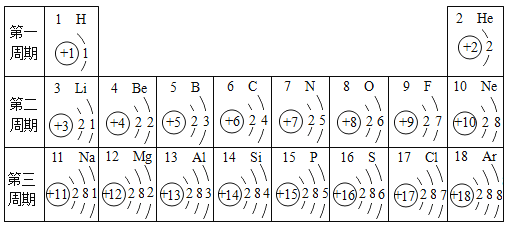
(1)在元素周期表中,原子结构相似的同族元素具有相似的化学性质。则下列各组元素具有相似化学性质的是______(填标号)。
A C和Ne B Be和Mg C Al和Si D F和S
(2)写出核外电子排布与氖原子相同的阳离子和阴离子符号各一个:阳离子______,阴离子______。
(3)在此周期表中,各元素的原子结构呈现的变化规律是:______依次递增。
【答案】B Na+(合理即可) F-(合理即可) 核电荷数(合理即可)
【解析】
(1)A、C和Ne不是同族元素,化学性质不相似,不符合题意;
B、Be和Mg是同族元素,化学性质相似,符合题意;
C、Al和Si不是同族元素,化学性质不相似,不符合题意;
D、F和S不是同族元素,化学性质不相似,不符合题意。
故填B。
(2)氖原子核外有10个电子,钠原子的最外层电子数为1,在化学反应中容易失去电子,从而带上一个单位的正电荷,形成钠离子,故钠离子的核外电子排布与氖原子相同,氟原子的最外层电子数为7,在化学反应中,容易得到电子,从而带上一个单位的负电荷,形成氟离子,故氟离子的核外电子排布与氖原子相同,故填:Na+;F-。
(3)在此周期中,各元素的原子结构呈现的变化规律是:核电荷数、原子序数、核外电子数依次递增。故填:核电荷数等。

练习册系列答案
相关题目