题目内容
现用98%的浓硫酸配制1000 mL溶质质量分数为20%的稀硫酸(密度为1.14 g/mL)。下列说法正确的是( )
| A.配制时应将水小心地加入浓硫酸中 |
| B.该稀硫酸中,溶剂质量:溶质质量=5:1 |
| C.实验中用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管等 |
| D.配制该稀硫酸需要加水800 mL |
C
分析:根据溶液配制的知识进行分析,浓硫酸密度比水大且溶于水放热,要将浓硫酸倒入水中,溶质质量分数为20%,则溶剂与溶质的质量比为4:1,稀释溶液时用到的玻璃仪器有烧杯、玻璃棒和量筒以及胶头滴管,根据溶质质量分数公式即可求得所需水的体积.
解答:解:A、浓硫酸密度比水大且溶于水放热,要将浓硫酸倒入水中,故A错误;
B、溶质质量分数为20%,则溶剂与溶质的质量比为4:1,故B错误;
C、稀释溶液时用到的玻璃仪器有烧杯、玻璃棒和量筒以及胶头滴管,故C正确;
D、浓硫酸加水稀释前后溶质硫酸的质量不变,设需要浓硫酸的质量为x,则有x×98%=1000mL×1.14g/mL×20%,解得x≈232.7g,所以水的质量为1000mL×1.14g/mL-232.7g=907.3g,所以水的体积为903.7mL,故D错误;
故选C.
解答:解:A、浓硫酸密度比水大且溶于水放热,要将浓硫酸倒入水中,故A错误;
B、溶质质量分数为20%,则溶剂与溶质的质量比为4:1,故B错误;
C、稀释溶液时用到的玻璃仪器有烧杯、玻璃棒和量筒以及胶头滴管,故C正确;
D、浓硫酸加水稀释前后溶质硫酸的质量不变,设需要浓硫酸的质量为x,则有x×98%=1000mL×1.14g/mL×20%,解得x≈232.7g,所以水的质量为1000mL×1.14g/mL-232.7g=907.3g,所以水的体积为903.7mL,故D错误;
故选C.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
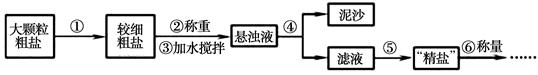 a.操作⑤中用到的仪器有铁架台、玻璃棒、酒精灯、坩埚钳、 (填序号)。
a.操作⑤中用到的仪器有铁架台、玻璃棒、酒精灯、坩埚钳、 (填序号)。