题目内容
【题目】水和溶液在生活、生产中具有广泛的用途。
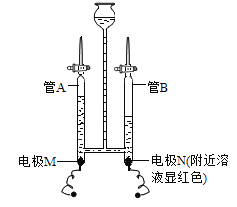
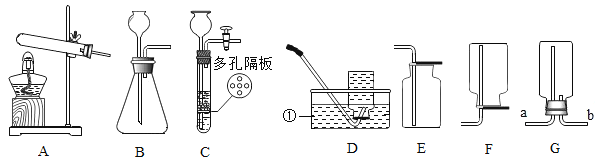
(1)某同学在水电解器中加入含酚酞的稀 Na2SO4 溶液(Na2SO4 溶液呈中性且不参与反应),至充满管 A和管B。通直流电一段时间后现象如下图所示。电解结束后将容器内所有液体倒入烧杯中,溶液呈无色。
①下列说法正确的是______(填字母)。
A 硫酸钠在水中解离出 Na+和 SO42-,可增强导电性
B 电解过程中化学能转化为电能
C 电极 N 与电源负极相连
D 管 A 中的气体与管 B 中的气体质量比 1:2
②电解过程中,电极 M 附近产生的微粒有______(填微粒符号)。
(2)生活中灭除水中细菌、降低自来水的硬度常用方法是______。
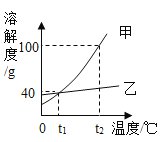
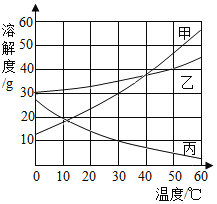
(3)如图是a、b、c 三种物质的溶解度曲线,请回答:

①当 a 中混有少量 b 时,可用______方法提纯 a;
②t1℃时物质 a 的饱和溶液中,溶质与溶剂质量比为______;
③t2℃时,在 100g 水中加入等质量的 a、b、c,充分搅拌后,所得溶液质量的大小关系可以是______。(填序号)
A a>b=c B a=b>c C a=b=c D a>b>c
【答案】AC O2、H+ 煮沸 降温结晶 1:5 BCD
【解析】
(1)①A、硫酸钠在水中解离出 Na+和 SO42-,可增强导电性,说法正确,符合题意;
B、水在通电的条件下分解为氢气和氧气,故是电能转化为化学能,不符合题意;
C、在电解水实验中,“正氧负氢”,生成氢气和氧气的体积比约为2:1,故电极 N 与电源负极相连,符合题意;
D、管 A 中的气体与管 B 中的气体体积比1:2,不是质量比,不符合题意。
故选AC;
②在电解水实验中,“正氧负氢”,生成氢气和氧气的体积比约为2:1,故电极M为正极,电极 M 附近产生了氧分子,电解中,电极N附件显红色,说明溶液显碱性,电解结束后将容器内所有液体倒入烧杯中,溶液呈无色,说明管A中溶液显酸性,电极M附近含有氢离子,故电极 M 附近产生的微粒有:O2、H+;
(2)生活中通常用煮沸的方法来降低水的硬度,消毒灭菌,故填:煮沸;
(3)①由图可知,a、b的溶解度随温度的升高而增加,且a的溶解度受温度的影响较大,b的溶解度受温度的影响较小,故当 a 中混有少量 b 时,可用降温结晶方法提纯 a;
②由图可知,t1℃时,物质 a 的溶解度为20g,故该温度下,物质a的饱和溶液中,溶质与溶剂质量比为:20g:100g=1:5;
③若加入的物质质量较少,a、b、c 均为不饱和溶液或c恰好达到饱和,则溶液质量 a=b=c;若加入的物质质量使 a、b 不饱和(或b恰好饱和)、c 饱和(有晶体析出),溶液质量 a=b>c;若加入的物质质量使 b、c 饱和(有晶体析出)a不饱和,b的溶解度大于c,则溶液质量 a>b>c;若加入物质质量使 a、b、c 饱和(有晶体析出),a的溶解度大于b大于c,则溶液质量 a>b>c。
故选BCD。

 考前必练系列答案
考前必练系列答案