题目内容
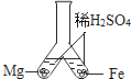
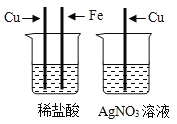
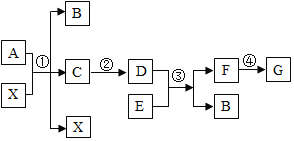
【题目】一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,李佳沛和张嘉鑫同学设计了如下实验方案:
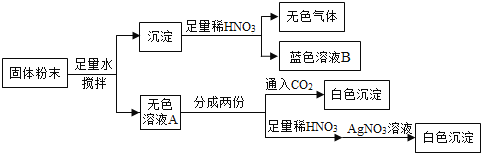
(1)无色气体X的化学式为____________________;
(2)据以上流程图分析,蓝色溶液B中的阳离子一定有________(填写化学符号);
(3)无色溶液A中一定有____________________(填写化学式);
(4)实验完毕时,张志昊将溶液A和溶液B进行混合,他发现无明显现象产生,请你帮忙分析原因__________;
(5)原固体粉末不能确定的物质是________。
【答案】CO2 Ca2+、Cu2+、H+ NaOH、NaCl、Ca(NO3)2 B中过量的硝酸将A中的氢氧化钠反应完全 NaNO3、NaCl
【解析】
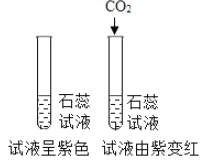
(1)据以上流程图分析,沉淀中加入稀硝酸,产生无色气体二氧化碳,说明沉淀中含有碳酸钙,无色气体是碳酸钙和稀硝酸反应生成的二氧化碳,二氧化碳的化学式是CO2。
故填:CO2。
(2)据以上流程图分析,沉淀中加入稀硝酸,产生无色气体二氧化碳,说明沉淀中含有碳酸钙,得到蓝色溶液,是因为氢氧化铜和稀硝酸反应生成了硝酸铜,因此蓝色溶液B中的阳离子一定有反应生成的硝酸钙中的钙离子、硝酸铜中的铜离子、过量稀硝酸中的氢离子。
故填:Ca2+、Cu2+、H+。
(3)无色溶液A中通入二氧化碳,产生白色沉淀,是因为二氧化碳和溶液中的氢氧化钠反应生成了碳酸钠,碳酸钠和硝酸钙反应生成白色沉淀碳酸钙,因此无色溶液A中一定有过量的氢氧化钠、氢氧化钠和氯化铜反应生成的氯化钠、硝酸钙。
故填:NaOH、NaCl、Ca(NO3)2。
(4)实验完毕时,张志昊将溶液A和溶液B进行混合,他发现无明显现象产生,即不产生蓝色沉淀,是因为B中过量的硝酸将A中的氢氧化钠反应完全。
故填:B中过量的硝酸将A中的氢氧化钠反应完全。
(5)原固体粉末不能确定的物质是硝酸钠、氯化钠,是因为无论是否含有硝酸钠,实验现象都一样,和硝酸银反应生成白色沉淀的氯化钠可能只是氯化铜和氢氧化钠反应生成的,也可能既有反应生成的,也有固体粉末中的。
故填:NaNO3、NaCl。

【题目】某校实验室有一瓶久置的铁屑,其成分是铁、氧化铁和水。为测定其中各成分的质量分数,某兴趣小组按下图所示装置进行实验(装置气密性良好;固定装置已略去;氮气不与铁屑中的成分反应;碱石灰是氧化钙和氢氧化钠的混合物)。
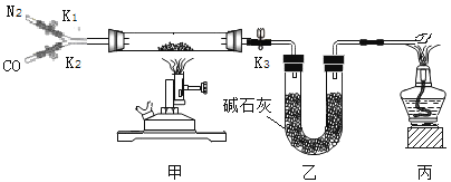
部分实验步骤如下:
Ⅰ.称量硬质玻璃管的质量。将样品放入硬质玻璃管中,称量硬质玻璃管和样品的质量。
II.连接好装置。缓缓通入N2,点燃甲处的酒精喷灯,待硬质玻璃管中固体恒重,记录硬质玻璃管和剩余固体的质量。
Ⅲ.再次连接好装置,继续实验。通入CO,点燃丙处的酒精灯和甲处的酒精喷灯。待硬质玻璃管中固体恒重,熄灭酒精喷灯,继续通入CO直至硬质玻璃管冷却。再次记录硬质玻璃管和剩余固体的质量。
实验数据记录如下表:
硬质玻璃管 | 硬质玻璃管和样品 | 步骤II硬质玻璃 管和剩余固体 | 步骤步骤Ⅲ硬质玻璃 管和剩余固体 | |
质量 | m1 | m2 | m3 | m4 |
请回答下列问题:
(1)步骤Ⅲ丙处酒精灯的作用是____________。
(2)步骤Ⅲ硬质玻璃管中反应的化学方程式为________。
(3)样品中氧化铁的质量分数为_____(用m1、m2、m3、m4的代数式表示)。若步骤Ⅲ中氧化铁没有完全反应,样品中水的质量分数测量结果将______(填“偏大”“偏小”或“不变”)。
(4)有关样品,下列说法正确的是_____(填字母标号)。
A样品中氢元素的质量为1/9(m2-m3) B样品中铁单质和氧化铁的质量总和为m3-m1
C样品中铁单质的质量为m4-m1 D样品中氧元素的质量为m3-m4