题目内容
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
Ⅰ.铁的应用
(1)下列铁制品的利用与金属导热性有关的是 (填字母,下同)。
A.铁钳 B.铁锅 C.刀具
(2)“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的 。
Ⅱ.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式: ;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能 ;
Ⅲ.实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4 ![]() CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;
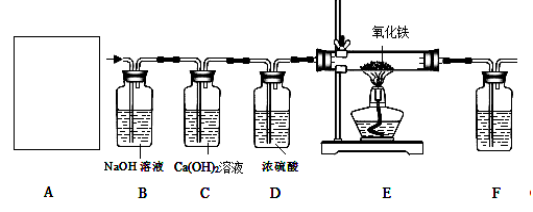
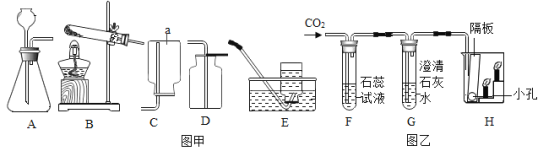
于是他设计了下图的实验装置,结合装置回答下列问题:
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的 (填装置编号);
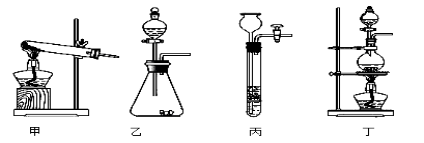
(2)图中装置C、D的作用分别是 、 ;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的 (填试剂名称),反应的化学方程式为 ;
(4)该装置设计有一个明显缺陷,你认为是 。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
查阅资料:a. 铁的氧化物在足量的稀盐酸中均能全部溶解。
b. Fe2O3与CO反应的固体生成物可能情况如下:
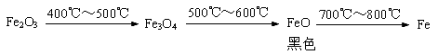
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;② ③ 。
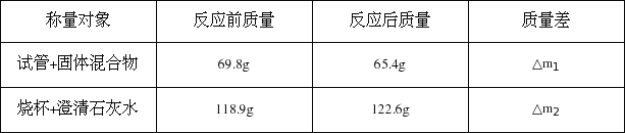
(6)定量分析 用电子天平称量得部分数据如下:
玻璃管质量 | 玻璃管及其中固体的质量 | 装置F及其中物质的总质量 | |
反应前 | 28.20 g | 33.00 g | 300.0 g |
反应后 | 32.84 g | 300.4 g |
根据上述数据,纯净的Fe2O3固体质量为 g,请选择有效的数据,推断出反应后黑色固体的成分。(写出计算过程) 。
根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:
【答案】Ⅰ.铁的应用
(1) B (2)氧气和水(或O2和H2O)
Ⅱ.铁的冶炼
(1)Fe2O3 + 3CO![]() 2Fe + 3CO2(2)提供热源,维持炉温
2Fe + 3CO2(2)提供热源,维持炉温
Ⅲ.实验探究炼铁原理
(1)丁 (2)证明CO2已经除尽 吸收水分(或干燥CO)
(3)澄清的石灰水(或氢氧化钙溶液) 略 (4)缺少尾气处理装置
(5)FeO Fe3O4和FeO
(6)4.8 Fe3O4 CO+3Fe2O3![]() 2Fe3O4+CO2
2Fe3O4+CO2
【解析】
试题分析:利用与金属导热性有关的是B.铁锅,α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的氧气和水分并发生反应。以赤铁矿为原料,在高温下炼铁的化学方程式Fe2O3+3CO![]() 2Fe + 3CO2,高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能提供热源,维持炉温,草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,为了便于控制反应所以应该选用丁装置,图中装置C、D的作用分别证明CO2已经除尽;利用浓硫酸的吸水性来吸收水分,黑色粉末不可能有三氧化二铁,所以可能的情况就是Fe3O4;FeO;Fe3O4和FeO三种情况,纯净的Fe2O3固体质量为:33.00g-28.20g=4.80g,其中铁元素的质量为4.80g× 112/160×100%=3.36g氧元素的质量为4.80g-3.36g=1.44g;反应后损失的氧元素的质量为33.00g-32.84g=0.16g,所以设反应后黑色固体FexOy,则铁元素:氧元素=56x:16y=3.36g:(1.44g-0.16g);解得x:y=3:4故反应后黑色固体是Fe3O4。反应的方程式根据提供的信息不难写出,主要是要注意配平及其标注条件。
2Fe + 3CO2,高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能提供热源,维持炉温,草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,为了便于控制反应所以应该选用丁装置,图中装置C、D的作用分别证明CO2已经除尽;利用浓硫酸的吸水性来吸收水分,黑色粉末不可能有三氧化二铁,所以可能的情况就是Fe3O4;FeO;Fe3O4和FeO三种情况,纯净的Fe2O3固体质量为:33.00g-28.20g=4.80g,其中铁元素的质量为4.80g× 112/160×100%=3.36g氧元素的质量为4.80g-3.36g=1.44g;反应后损失的氧元素的质量为33.00g-32.84g=0.16g,所以设反应后黑色固体FexOy,则铁元素:氧元素=56x:16y=3.36g:(1.44g-0.16g);解得x:y=3:4故反应后黑色固体是Fe3O4。反应的方程式根据提供的信息不难写出,主要是要注意配平及其标注条件。

 阅读快车系列答案
阅读快车系列答案【题目】某密闭容器内有X、Y、Z、W四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | X | Y | Z | W |
反应前质量 | 4 | 1 | 10 | 2 |
反应后质量 | 待测 | 5 | 4 | 8 |
下列说法正确的是![]()
![]()
A. 反应后X的质量为8g
B. Z与W的相对分子质量比一定是1:1
C. 该反应的反应物只有Z
D. 参加反应的X与Z的质量比是2:3