题目内容
【题目】如图是氯化钠和碳酸钠的溶解度曲线。据图回答问题:
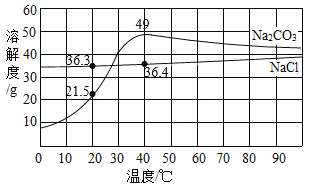
(1)纯碱是一种重要的化工原料,工业上主要利用从海水中获得的食盐来制备纯碱,其反应的化学方程式是_______________,__________________;
(2)工业制碱的过程中,哪种物质首先从溶液中结晶析出_________,为什么______________;
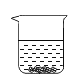
(3)为确定某白色固体是碳酸钠还是氯化钠,在20℃时,取2.5g样品加入盛有10g水的烧杯中,充分搅拌后现象如图所示,则固体粉末是_____________。若将该溶液升温到40℃时,则所得溶液溶质质量分数为________。
【答案】NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl 2NaHCO3![]() Na2CO3+H2O+CO2↑ 碳酸氢钠 常温下,氯化铵的溶解度较大,碳酸氢钠的溶解度较小 碳酸钠 20%
Na2CO3+H2O+CO2↑ 碳酸氢钠 常温下,氯化铵的溶解度较大,碳酸氢钠的溶解度较小 碳酸钠 20%
【解析】
(1)工业上主要利用从海水中获得的食盐来制备纯碱的化学方程式是:NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl,2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(2)常温下,氯化铵的溶解度较大,碳酸氢钠的溶解度较小,故工业制碱的过程中,首先从溶液中结晶析出的是碳酸氢钠;
(3)在20℃时,取2.5g样品加入盛有10g水的烧杯中,充分搅拌后有部分固体没有溶解,则在20℃时,该固体的溶解度<25g,20℃时,碳酸钠的溶解度为21.5g,21.5g<25g,氯化钠的溶解度为36.3g,故该固体粉末是碳酸钠。若将该溶液升温到40℃时,2.5g样品全部溶解,则所得溶液溶质质量分数为:![]() =20%。
=20%。

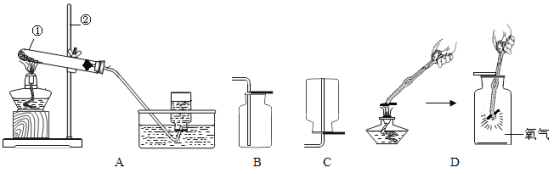
【题目】某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究氯酸钾和二氧化锰的质量比对反应速率的影响。
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
小芳在实验时,误把氧化铜当作二氧化锰放入加热,结果发现也能较快产生氧气,于是进行如下探究:
猜想Ⅰ:除二氧化锰、氧化铜外,氧化铁(Fe2O3)也可以作氯酸钾分解的催化剂。
(设计实验)按下表进行实验,并测定开始产生气体时的温度(提示:开始产生气体的温度越低,表示反应速度越快)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾和二氧化锰(质量比1︰1) | 350 |
③ | 氯酸钾和氧化铜(质量比1︰1) | 370 |
④ | 氯酸钾和氧化铁(质量比1︰1) | 390 |
(数据和结论)
(1)由实验_______与实验④对比,证明猜想合理;
(2)实验所用的三种物质中,催化效果最好的是_______。
(反思)
若要证明氧化铁是该反应的催化剂,还需验证它在化学反应前后的________和_______是否改变。
猜想Ⅱ:过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应可制取氧气。
(分析与反思)
同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气
你认为猜想______(填序号)一定是错误的,理由是________,过氧化钙与水反应虽然没有快速收集到大量氧气,但过氧化钙在水中持续、缓慢放出氧气,因此小林认为渔民用过氧化钙做增氧剂。写出此反应的符号表达式________。
(计算)
该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示。试计算:

(1)过氧化钙的相对分子质量为_______
(2)该产品中过氧化钙的质量分数至少为______。
(3)小组同学将3g某物质在制得的足量氧气中充分燃烧生成4.4g二氧化碳和1.8g水,求该物质中各元素的原子个数比(写出计算过程)。______
【题目】20℃时,取甲、乙、丙、丁四种物质各20g,分别加入到四个盛有50 g水的烧杯中,充分溶解,情况如下表(温度保持20℃),下列说法正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
未溶解固体的质量/g | 4.2 | 2 | 0 | 9.2 |
A.所得溶液一定都是饱和溶液
B.溶质质量分数最大的是丙溶液
C.所得四种溶液的质量关系为:甲=乙=丙=丁
D.20℃时四种物质溶解度的关系为:丁>甲>乙>丙