题目内容
【题目】银铜合金广泛用于航空工业,以下为从航空切割废料中回收银并制备CuAlO2的工艺流程。

(资料)
Ⅰ.难溶碱受热易分解为两种氧化物,Cu(OH)2、Al(OH)3完全分解的温度分别为80℃和450℃;
Ⅱ.CuAlO2高温易分解、受热易氧化,银在空气中不易被氧化。
请回答下列问题:
(1)可将铜丝浸入_____溶液中来验证铜、银两种金属的活动性强弱。
(2)固体B在煅烧时发生的其中一个反应方程式为4CuO+2Al2O3 ![]() 4CuAlO2+X↑,气体X的化学式为___________,CuAlO2中铜元素的化合价为________。
4CuAlO2+X↑,气体X的化学式为___________,CuAlO2中铜元素的化合价为________。
(3)滤液A中发生化学反应的方程式(任选一个)____,煮沸过程中发生反应的化学方程式为__。
(4)“煅烧”时温度须控制在1042~1085℃范围内且在氩气中进行,其目的是______。
【答案】硝酸银 O2 +1 2NaOH+H2SO4=Na2SO4+2H2O或2NaOH+CuSO4=Cu(OH)2↓+Na2SO4或 Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4 Cu(OH)2![]() CuO+H2O 为了防止温度过高CuAlO2分解和被氧化
CuO+H2O 为了防止温度过高CuAlO2分解和被氧化
【解析】
(1)金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,所以可将铜丝浸入硝酸银溶液中来验证铜、银两种金属的活动性强弱。
(2)反应前有4Cu、10O、4Al,反应后(X除外)有4Cu、8O、4Al,根据化学反应前后各种原子个数相等,所以气体X的化学式为O2。CuAlO2中氧元素的化合价为-2,铝元素的化合价为+3,根据化合物中各元素化合价的代数和为零,铜元素的化合价为+1。
(3)氧化铜与稀硫酸反应生成硫酸铜和水,所以滤液A中含有剩余的H2SO4和生成的CuSO4,加入氢氧化钠溶液和硫酸铝,则氢氧化钠会和稀硫酸反应生成生成硫酸钠和水,2NaOH+H2SO4=Na2SO4+2H2O,氢氧化钠会与硫酸铜反应生成氢氧化铜和硫酸钠,2NaOH+CuSO4 =Cu(OH)2↓+Na2SO4,氢氧化钠会与硫酸铝反应生成氢氧化铝和硫酸钠,Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4。煮沸,温度最高能达到100℃,由于Cu(OH)2、Al(OH)3完全分解的温度分别为80℃和450℃,所以煮沸过程中发生的反应是Cu(OH)2的分解反应,发生化学反应的方程式是:Cu(OH)2![]() CuO+H2O。
CuO+H2O。
(4)“煅烧”时温度须控制在1042~1085℃范围内且在氩气中进行,其目的是为了防止温度过高CuAlO2分解和被氧化。

 新思维假期作业寒假吉林大学出版社系列答案
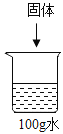
新思维假期作业寒假吉林大学出版社系列答案【题目】已知:20℃时,NaCl和NaNO3的溶解度分别为36 g和88 g。
| 序号 | ① | ② | ③ | ④ | ⑤ |
固体种类 | NaCl | NaCl | NaNO3 | NaNO3 | NaNO3 | |
固体的质量/g | 30 | 60 | 30 | 60 | 90 | |
水的质量/g | 100 | 100 | 100 | 100 | 100 |
上表是20℃时实验得出的数据,根据该数据,则下列关于①~⑤所得溶液的说法不正确的是
A. 溶质质量:②=④B. 溶液质量: ①<②
C. 溶质质量分数:①=③D. ⑤中溶质与溶剂的质量比为22:25