题目内容
(6分)
做完酸、碱、盐相关性质实验后,某实验小组不小心把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合在一起,看到有大量气泡生成。他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究。
【提出问题】反应后溶液中溶质的成为是什么?
【猜想假设】猜想① Na2SO4、Na2CO3 猜想② Na2SO4、Na2CO3、NaOH
猜想③ Na2SO4、H2SO4、Na2CO3 猜想④ Na2SO4、 H2SO4
猜想⑤ Na2SO4
上述猜想中,你认为不合理的是猜想 (填序号)。
【实验探究】(1)甲同学取少量该溶液于试管中,向其中滴加无色酚酞,发现溶液颜色无变化,据此,他认为猜想⑤是正确的。你认为他的结论是 (填“合理”或“不合理”)的,理由是 。
(2)乙同学向盛有一根生锈的铁钉的试管中加入适量该溶液,过一会儿取出铁钉,用水洗净,观察到铁锈消失,铁钉变得光亮,溶液变黄。该反应的化学方程式是 。
【实验结论】根据上述实验探究,你认为猜想 (填序号)是正确的。
【拓展应用】工厂与实验室的酸性废水必须处理至中性再排放,这样做的意义是 (答一点即可)。
②③ (1) 不合理 无色酚酞试液遇酸性或中性溶液均不变色
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
④ 防止污染水体或防止腐蚀铁质下水道
解析试题分析:【猜想假设】稀硫酸、氢氧化钠溶液和碳酸钠溶液混合在一起,稀硫酸是先与氢氧化钠溶液反应,再与碳酸钠溶液反应,所以刚开始时没有气泡产生,看到有大量气泡生成,说明氢氧化钠溶液已反应完,所以猜想②不正确,两种反应物H2SO4和Na2CO3会继续反应,不能共存,所以猜想③也不正确
【实验探究】(1)取少量该溶液于试管中,向其中滴加无色酚酞,发现溶液颜色无变化,只能说明溶液不显碱性,所以认为猜想⑤是正确的结论是:不合理,理由是:无色酚酞试液遇酸性或中性溶液均不变色
(2)生锈的铁钉的试管中加入适量该溶液,观察到铁锈消失,铁钉变得光亮,溶液变黄。该反应的化学方程式是:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
【实验结论】根据上述实验探究,你认为猜④想是正确的
【拓展应用】工厂与实验室的酸性废水必须处理至中性再排放,这样做的意义是:防止污染水体或防止腐蚀铁质下水道
考点:反应后溶液成分的探究,酸的化学性质

 发散思维新课堂系列答案
发散思维新课堂系列答案(8分)常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。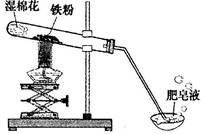
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。 说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
| 实验操作 | 实验现象及结论 |
| | |
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。
科学探究是奇妙的过程,请你一起参与并填写下列空白。
【提出问题】小森同学在滴加FeCl3溶液时,不小心把滴加FeCl3溶液的滴管放入到盛“双
氧水”(过氧化氢)的试剂瓶中,发现有大量的气泡产生。小森联想到用二氧化锰可作为过氧化氢的催化剂,他想FeCl3溶液能否也可以作为过氧化氢分解的催化剂呢?于是他做了以下探究。
【猜想与假设】FeCl3溶液能作过氧化氢分解的催化剂
【设计与实验】
| 实验步骤 | 实验现象 | 实验结论 |
| 在一支试管中加入5mL15%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管 | | FeCl3溶液可以催化分解H2O2 |
已知FeCl3溶液中含有H2O 、Fe3+和Cl-三种微粒,小森同学又做了三种猜想:
猜想1:真正催化分解H2O2的是FeCl3溶液中的H2O
猜想2:真正催化分解H2O2的是FeCl3溶液中的Fe3+
猜想3:真正催化分解H2O2的是FeCl3溶液中的CI—
你认为最不可能的是哪一种猜想, 。小森同学认为,要验证猜想,至少还需要做 个对比实验。
(11分)实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究:
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 。
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ. Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
这瓶试剂不可能是 。
【作出猜想】①可能是 溶液;②可能是Na2CO3溶液;③可能是NaCl。
【设计并实验】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是。
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中, 滴加氢氧化钙溶液 | | 猜想②正确 相关的化学方程式 |
小华同学用上述溶液对实验室制取CO2气体的废液进行后续探究,他向100克的废液中逐滴加入上述Na2CO3溶液。实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图1所示;加入Na2CO3溶液的质量与溶液的PH变化关系如图2所示

(3)小华同学所取废液中的溶质含
(4)图1中b→c段反应过程中溶液的PH变化情况可用图2中 段表示
(5)图1中b和x的值分别为 克和 克