题目内容
稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%, 含Fe2O3、CuO、SiO2等约30%)生产大颗粒-氧化钇的一种工艺如下:
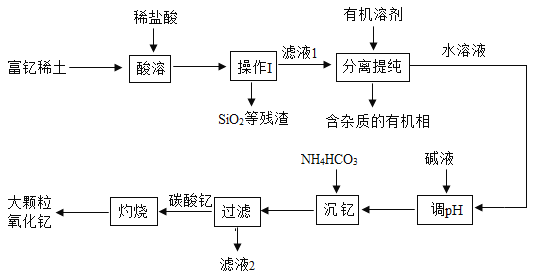
(1)操作I的名称是_____。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______。
(3)“分离提纯”是为了除去滤液1中的_____(填化学式)。
(4)“调pH”时加入碱液使溶液的pH_____(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是_____,此反应属于基本反应类型中的_____反应。
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案某化学兴趣小组的同学在学习九年级《化学》下册中的资料卡片“石笋和钟乳石的形成”时,发现难溶于水的碳酸钙当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O═Ca(HCO3)2,联想到实验室中澄清石灰水与二氧化碳反应会生成碳酸钙:Ca(OH)2+CO2═CaCO3↓+H2O,对长时间向碱溶液中通入CO2,反应后溶液中的溶质组成产生了浓厚的兴趣。
(提出问题)一定量CO2与NaOH溶液反应后的溶质组成是什么?
(查阅资料)
(1)通入少量CO2反应的化学方程式为______。
(2)通入过量CO2,反应的化学方程式为Na2CO3+CO2+H2O═2NaHCO3。
(3)碳酸氢盐都是可溶于水的,BaCO3难溶于水。
(4)碳酸氢钠溶液呈碱性。
(提出猜想)
(1)溶质为NaOH和Na2CO3;
(2)溶质为Na2CO3;
(3)溶质为______(填化学式);
(4)溶质为NaHCO3。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
(1)用玻璃棒蘸取反应后溶液,滴在pH试纸上 | pH=9 | 该溶液显 ______ 性 |
(2)取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液 | 有 ______ 生成 | 猜想(4)不成立 |
(3)取步骤(2)中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想 ______ 不成立 |
(得出结论)猜想(3)成立。
(讨论交流)
(1)有同学提出,实验步骤(1)是多余的。你认为该实验设计是否需要?______(填“需要”或“不需要”)。
(2)同学们又一次把目光投向了教材,发现遇热或压强变小时:Ca(HCO3)2═CaCO3↓+CO2↑+H2O,纷纷提出,干粉灭火器中用NaHCO3灭火的反应原理与之相似,试写出NaHCO3受热分解的化学方程式:______ 。
(反思应用)向澄清石灰水中不断通入二氧化碳,观察到的现象是______。
如图是“部分酸、碱和盐的溶解性表(室温)”中的一部分,据此判断下列说法正确的是( )

A.“溶挥”处物质的溶液具有挥发性
B.“微”处物质的化学式为Mg2CO3
C.氢氧化镁能溶于水
D.“溶”处的物质属于碱
元素周期表是我们学习和研究化学的重要工具,它的内容十分丰富。下面是元素周期表部分内容,请回答下列问题
1 | 1 H 氢 | 2 He 氦 | ||||||
2 | 3 Li 锂 | 4 Be 铍 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10Ne 氖 |
3 | 11Na钠 | 12Mg镁 | 13Al铝 | 14Si硅 | 15P 磷 | 16S 硫 | 17____ 氯 | 18 Ar 氩 |
(1)在元素周期表中,原子序数为17的元素符号是________,在化学反应中该原子易 ________________(填“得到”或“失去”)电子。
(2)表中不同种元素最本质的区别是______(填序号)
A 质子数不同 B 中子数不同 C 相对原子质量不同

