��Ŀ����
������ij�о�С��̽��Ӱ�췴Ӧ���ʲ������ص����ʵ�����ݣ�| ʵ�� ��� | H2O2��Һ Ũ��% | H2O2��Һ ���/mL | �¶ȡ� | MnO2�� ����/g | �ռ������� ���/mL | ��Ӧ����� ʱ��/s |
| �� | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| �� | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| �� | 30 | 5 | 35 | 2 | 49.21 | |
| �� | 30 | 5 | 55 | 2 | 10.76 |
��2����ʵ��______�Աȿ�֪����ѧ��Ӧ���ʺ��¶ȵĹ�ϵ��______��
��3����ѧ��Ӧ��ʵ������������Ӵ�����ײ�Ľ������ѧ��Ӧ�����������ӵ���ײ���йأ��Դ��۽ǶȽ��͡���Ӧ��Ũ��Խ��ѧ��Ӧ����Խ�족��ԭ���ǣ�______��
��4��ijͬѧ��ʵ����������ʦ�ṩ�Ĺ���������Һ�Ͷ������̵Ļ����Ϊԭ����ȡ������һ��ʱ���������0.16g���Լ����������Ҫ������������ʵ����������ݻ�ѧ����ʽ��ʽ���㣩
������ˮ______�ˣ�
���𰸡���������1���٢��ǹ�������Ũ�Ȳ�ͬ������������ͬ�������������֤��Ӧ��Ũ�ȶԷ�Ӧ�ٶȵ�Ӱ�죻
��2���ۢ������¶Ȳ�ͬ����������ͬ���Ƕ��¶�Ӱ�컯ѧ��Ӧ�ٶȵ�̽����
��3����Ӧ��ԽŨ����Һ�����ӵ��ܶȻ�������Ӽ��ϵĻ�����࣬����ʱӦ�����������֣�
��4�������������������û�ѧ��Ӧ����ʽ�������������������ʵ����Լ�ˮ���������н��
����⣺��1���٢��ǹ�������Ũ�Ȳ�ͬ������������ͬ�������������֤��Ӧ��Ũ�ȶԷ�Ӧ�ٶȵ�Ӱ�죻�����Ӧ��Ũ�ȣ�
��2����ʵ��ۺܿ͢�֪�¶�Խ�ߣ���ѧ��Ӧ����Խ�죻����ۺ͢ܣ��¶�Խ�ߣ���ѧ��Ӧ����Խ�죻
��3����Ӧ��Ũ��Խ��ѧ��Ӧ����Խ�족��ԭ���ǣ���Ӧ��Ũ��Խ��Ӧ����ӵļ�϶ԽС����ײ��Խ��ѧ��Ӧ����Խ�죻�����Ӧ��Ũ��Խ��Ӧ����ӵļ�϶ԽС����ײ��Խ��ѧ��Ӧ����Խ�죻
��4���⣺�������������������ʵ���Ϊx������ˮ�����ʵ���Ϊy��
n��O2��=0.16g/��32g/mol��=0.005mol
2H2O2 2H2O+O2��
2H2O+O2��
2 2 1
x y 0.005mol
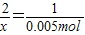
x=0.01mol
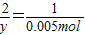
y=0.01mol
�������������������ʵ���Ϊ0.01mol��
��ˮ������=0.01mol×18g/mol=0.18g�����0.18��
���������⿼����ѧ����ͼ���ķ����������漰��Ӱ�컯ѧ��Ӧ���ٶȣ����۽�����Һ��Ӧ��ʵ�ʣ�
��2���ۢ������¶Ȳ�ͬ����������ͬ���Ƕ��¶�Ӱ�컯ѧ��Ӧ�ٶȵ�̽����
��3����Ӧ��ԽŨ����Һ�����ӵ��ܶȻ�������Ӽ��ϵĻ�����࣬����ʱӦ�����������֣�
��4�������������������û�ѧ��Ӧ����ʽ�������������������ʵ����Լ�ˮ���������н��
����⣺��1���٢��ǹ�������Ũ�Ȳ�ͬ������������ͬ�������������֤��Ӧ��Ũ�ȶԷ�Ӧ�ٶȵ�Ӱ�죻�����Ӧ��Ũ�ȣ�
��2����ʵ��ۺܿ͢�֪�¶�Խ�ߣ���ѧ��Ӧ����Խ�죻����ۺ͢ܣ��¶�Խ�ߣ���ѧ��Ӧ����Խ�죻
��3����Ӧ��Ũ��Խ��ѧ��Ӧ����Խ�족��ԭ���ǣ���Ӧ��Ũ��Խ��Ӧ����ӵļ�϶ԽС����ײ��Խ��ѧ��Ӧ����Խ�죻�����Ӧ��Ũ��Խ��Ӧ����ӵļ�϶ԽС����ײ��Խ��ѧ��Ӧ����Խ�죻
��4���⣺�������������������ʵ���Ϊx������ˮ�����ʵ���Ϊy��
n��O2��=0.16g/��32g/mol��=0.005mol
2H2O2
 2H2O+O2��
2H2O+O2��2 2 1
x y 0.005mol
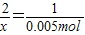
x=0.01mol
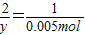
y=0.01mol
�������������������ʵ���Ϊ0.01mol��
��ˮ������=0.01mol×18g/mol=0.18g�����0.18��
���������⿼����ѧ����ͼ���ķ����������漰��Ӱ�컯ѧ��Ӧ���ٶȣ����۽�����Һ��Ӧ��ʵ�ʣ�

��ϰ��ϵ�д�
 �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д� �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
�����Ŀ