题目内容
【题目】矿山废水中含有大量的H2SO4和CuSO4,直接排放会影响水体酸碱性,并造成重金属污染。通过处理可以回收金属铜,并使废水pH和重金属离子含量达到排放标准。
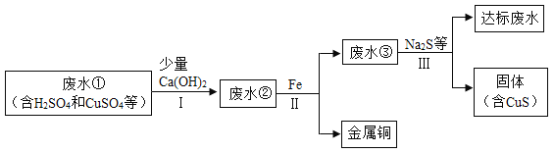
已知:步骤I中Ca(OH)2与CuSO4并没有发生反应; CuSO4 属于一种常见的重金属盐。
(1)废水①中一定含有的阳离子有______________。
(2)步骤II和步骤Ⅲ都需进行的操作是______________,实验室进行该操作是用到的一种玻璃仪器是______________。
(3)步骤II得到金属铜的化学反应方程式为______________。
(4)加入少量Ca(OH)2可以降低步骤II中铁的消耗量,原因是______________。
(5)步骤Ⅲ需加入Na2S才能使废水达到排放标准,由此推测废水③不达标的主要原因是其中还含有较多的______________,(填化学式或离子符号) ;达标废水pH比废水①pH____________(填“大”或“小”)。
【答案】H+、Cu2+ 过滤 漏斗 Fe+CuSO4=Cu+FeSO4 Ca(OH)2会与废水中的硫酸发生反应,消耗了废水中的硫酸,减少了铁屑与硫酸的反应 CuSO4(或Cu2+) 大
【解析】
(1)硫酸是由氢离子与硫酸根离子构成的,硫酸铜是由铜离子与硫酸根离子构成的,所以废水①中一定含有的阳离子有氢离子与铜离子;故填:H+、Cu2+;
(2)步骤Ⅱ和步骤Ⅲ的操作均是将固体和液体分离,所以操作是过滤。过滤需要的玻璃仪器有烧杯、玻璃棒和漏斗;故填:过滤;漏斗;
(3)步骤Ⅱ中加入铁屑得到金属铜,只能是铁和硫酸铜发生反应,化学方程式为Fe+CuSO4=Cu+FeSO4;故填:Fe+CuSO4=Cu+FeSO4;
(4)步骤Ⅰ中加入少量Ca(OH)2,无蓝色沉淀生成可知加入的Ca(OH)2只与废水中的硫酸发生反应,这样减少了铁屑与硫酸的反应,使铁屑可以与硫酸铜充分反应。故填:Ca(OH)2会与废水中的硫酸发生反应,消耗了废水中的硫酸,减少了铁屑与硫酸的反应;
(5)步骤Ⅲ加入Na2S后,生成CuS沉淀和达标废水,所以不达标废水中一定含有CuSO4(或Cu2+)。达标废水中的硫酸被除去,所以其pH比废水①pH大;故填:CuSO4(或Cu2+);大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】现有一家庭食用纯碱样品,其中含杂质氯化钠(不含其他杂质),为了测定样品中杂质氯化钠的质量分数,李明同学进行了三次实验。实验数据如下表:
编号 | 第1次 | 第2次 | 第3次 |
所取固体样品的质量g | 15 | 12 | 12 |
加入氯化钙溶液的质量/g | 100 | 100 | 150 |
反应后生成沉淀的质量/g | 10 | 10 | 10 |
完成下列计算(计算结果精确到0.1%):
(1)第_______次实验是恰好完全反应。
(2)加入氯化钙溶液的溶质质量分数。______
(3)样品中氯化钠的质量分数。_______