题目内容
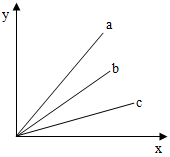 (2013?郑州二模)a、b、c分别代表镁、铝、铁三种金属中的一种,它们与酸反应生成氢气的关系图如下,x轴表示和酸反应的金属质量,y轴表示产生的氢气质量,则下列说法正确的是( )
(2013?郑州二模)a、b、c分别代表镁、铝、铁三种金属中的一种,它们与酸反应生成氢气的关系图如下,x轴表示和酸反应的金属质量,y轴表示产生的氢气质量,则下列说法正确的是( )分析:根据产生氢气的质量与反应掉的金属的关系图,等质量的金属产生氢气的质量关系是a>b>c,根据一定量金属完全反应产生氢气质量=
×金属的质量,确定出abc对应的金属分别是铝、镁、铁,然后分析判断选项正误.
| 金属的化合价 |
| 金属的相对原子质量 |
解答:解:根据产生氢气的质量与反应掉的金属的关系图,等质量的金属产生氢气的质量关系是a>b>c,根据一定量金属完全反应产生氢气质量=
×金属的质量,设金属质量都为m,则铝、镁、铁与足量酸反应产生氢气的质量分别为
×m,
×m,
×m,因此a为铝、b为镁、c为铁.
A、由上述分析可知a、b、c对应的金属分别是铝、镁、铁,根据金属活动性顺序表可知三种金属的活动性由强到弱的顺序为镁、铝、铁,故活动性顺序为b>a>c,故A错误;
B、由上述分析可知a为铝、b为镁、c为铁,故B正确;
C、生成物中铝为+3价,铁为+2价,镁为+2价,故生成物中金属元素的化合价为a>b=c,故C错误;
D、铝、镁、铁的相对原子质量分别为27、24、56,故金属相对原子质量是b<a<c,故D错误;
故选B
| 金属的化合价 |
| 金属的相对原子质量 |
| 3 |
| 27 |
| 2 |
| 24 |
| 2 |
| 56 |
A、由上述分析可知a、b、c对应的金属分别是铝、镁、铁,根据金属活动性顺序表可知三种金属的活动性由强到弱的顺序为镁、铝、铁,故活动性顺序为b>a>c,故A错误;
B、由上述分析可知a为铝、b为镁、c为铁,故B正确;
C、生成物中铝为+3价,铁为+2价,镁为+2价,故生成物中金属元素的化合价为a>b=c,故C错误;
D、铝、镁、铁的相对原子质量分别为27、24、56,故金属相对原子质量是b<a<c,故D错误;
故选B
点评:一定量金属完全反应产生氢气质量=
×金属的质量,根据氢气与金属质量之间的关系可确定金属种类.
| 金属的化合价 |
| 金属的相对原子质量 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 (2013?郑州二模)将密封良好的、未变质的方便烩面从郑州带到青藏高原时包装袋会鼓起(如图),是因为袋内气体的( )
(2013?郑州二模)将密封良好的、未变质的方便烩面从郑州带到青藏高原时包装袋会鼓起(如图),是因为袋内气体的( ) (2013?郑州二模)实验室用如图所示装置制取和收集氧气,下列说法“不正确”的是( )
(2013?郑州二模)实验室用如图所示装置制取和收集氧气,下列说法“不正确”的是( )