题目内容
(8分) “侯氏制碱法”制得的纯碱(Na2CO3)中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中Na2CO3的质量分数。
【方案一】沉淀分析法(如下图所示)。

(1)溶液M含有的溶质是CaCl2和 ;沉淀N的化学式是 。
【方案二】气体分析法
称取该纯碱样品21.5g,加入到盛有150 g的稀盐酸的烧杯中,样品完全反应后,测得烧杯内混合物的质量为162.7 g。
(2)写出实验室检验反应中生成气体的化学方程式: 。
(3)求该纯碱样品中Na2CO3的质量分数。(写出具体计算过程) 。
(4)假如称量准确,通过计算得到的纯碱样品中Na2CO3的质量分数比实际数值偏小,你认为其中可能的原因是 。
【方案一】沉淀分析法(如下图所示)。

(1)溶液M含有的溶质是CaCl2和 ;沉淀N的化学式是 。
【方案二】气体分析法
称取该纯碱样品21.5g,加入到盛有150 g的稀盐酸的烧杯中,样品完全反应后,测得烧杯内混合物的质量为162.7 g。
(2)写出实验室检验反应中生成气体的化学方程式: 。
(3)求该纯碱样品中Na2CO3的质量分数。(写出具体计算过程) 。
(4)假如称量准确,通过计算得到的纯碱样品中Na2CO3的质量分数比实际数值偏小,你认为其中可能的原因是 。
(8分)(1)NaCl; CaCO3 (各1分); (2)Ca(OH)2+ CO2= CaCO3↓+ H2O (2分) ;
(3)生成二氧化碳的质量为:21.5g+150g-162.7 g= 8.8g 设Na2CO3的质量为x
Na2CO3+2HCl==2NaCl+H2O+CO2↑(1分)
106 44
x 8.8g
106∶44=x∶8.8g
x =21.2g (1分)
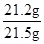 ×100%=98.6% (1分)
×100%=98.6% (1分)
(4)部分CO2溶于水(或CO2没有及时全部排出)(1分)
(3)生成二氧化碳的质量为:21.5g+150g-162.7 g= 8.8g 设Na2CO3的质量为x
Na2CO3+2HCl==2NaCl+H2O+CO2↑(1分)
106 44
x 8.8g
106∶44=x∶8.8g
x =21.2g (1分)
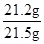 ×100%=98.6% (1分)
×100%=98.6% (1分)(4)部分CO2溶于水(或CO2没有及时全部排出)(1分)
试题分析:【方案一】(1)根据溶液M含有的溶质是CaCl2说明加入x的溶液是氯化钙溶液,氯化钙和碳酸钠反应生成氯化钠和碳酸钙沉淀,故溶液M含有的溶质是CaCl2和NaCl,沉淀N的化学式是CaCO3;【方案二】
(2)碳酸钠和稀盐酸反应生成氯化钠、水、二氧化碳,二氧化碳通常用澄清的石灰水检验,写出反应的化学方程式;(3)根据题中信息结合质量守恒定律求出二氧化碳的质量,再用化学方程式计算即可;(4)根据部分CO2 溶于水解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目