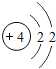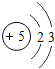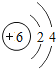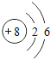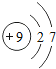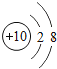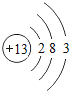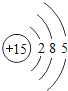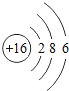题目内容
【题目】放电条件下,氮气能和氧气化合生成一氧化氮,一氧化氮在常温下能与氧气迅速化合生成二氧化氮,二氧化氮溶于水生成硝酸;在高温、高压、催化剂的条件下,氮气能与氢气化合反应生成氨气(C),进而生产出尿素(D) 等其它的氮肥。请根据下列物质的微观示意图回答问题。

(1) 四种物质中,属于氧化物的是__________(填序号)。
(2)每个D分子是由______个原子构成的。
(3)氨气(C)中氮元素的化合价为______。若氮元素的化合价为+5,其氧化物的化学式为______。
(4)写出A→B反应的化学方程式:___________,基本反应类型为_______。A、B两种物质的组成元素相同,但化学性质不同的理由是_________(从微观角度解释)。
【答案】AB 8 -3 N2O5 2NO+O2=2NO2 化合反应 A、B两种物质由不同种分子构成(合理即可)
【解析】
(1)由四种物质的微观构成可知,A、B都是由氮、氧两种元素组成的化合物,属于氧化物的。
(2)由微粒的构成可知,每个D分子是由8个原子构成的;
(3)氨气中,氢元素的化合价为+1价,则氮元素的化合价为-3;若氮元素的化合价为+5,氧的化合价为-2价,则其氧化物的化学式为:N2O5。
(4)由题意可知,A→B是一氧化氮和氧气反应生成了二氧化氮,反应的化学方程式是:2NO+O2═2NO2,符合“多变一”的特征,属于化合反应;
A、B两种物质的组成元素相同,但化学性质不同的理由是A、B两种物质由不同种分子构成。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
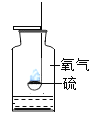
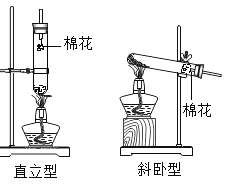
小题狂做系列答案【题目】某兴趣小组同学阅读产品标签发现,市售化学纯或分析纯高锰酸钾的纯度高达![]() ,含水量可以忽略不计。小组同学设计了直立型装置制取氧气,并与传统斜卧型装置相比较,如图,各放入5g高锰酸钾,用同一酒精灯分别加热,每组进行五次实验后取平均值。
,含水量可以忽略不计。小组同学设计了直立型装置制取氧气,并与传统斜卧型装置相比较,如图,各放入5g高锰酸钾,用同一酒精灯分别加热,每组进行五次实验后取平均值。
装置类型 | 收集1瓶氧气所需时间 | 收集2瓶氧气所需时间 | 生成氧气的总体积 |
直立型 |
|
| 552mL |
斜卧型 |
|
| 456mL |
(1)小组同学用直立型装置制取氧气时,不需在试管口放一团棉花的原因是______。
(2)等质量的高锰酸钾充分反应,斜卧型装置收集到的氧气较少的主要原因是______。
(3)收集等体积氧气,所需时间较短的装置是______;原因是______。
A 试管底部被火焰充分包围,升温快
B 药品受热面积大,温度高
C 加热过程中无需移动火焰,药品处于持续高温中。
(4)根据高锰酸钾的质量算出的氧气体积为理论值。实验中发现,两种装置制取的氧气质量均明显大于理论值,同学们对其原因进行了探究。
(提出猜想)
猜想1:可能是反应生成的二氧化锰在较高温度下受热分解放出氧气
猜想2:可能是反应生成的锰酸钾在较高温度下受热分解放出氧气
猜想3:______。作出以上猜想的理由是______。
(实验验证)实验a:取一定量的二氧化锰于试管中,加热一段时间,冷却后测得二氧化锰的质量不变,证明猜想______错误。
实验b:取少量锰酸钾于试管中,加热一段时间,冷却,若______则猜想2正确。
【题目】下图为实验室制取某些气体的装置示意图,请按要求回答有关问题:
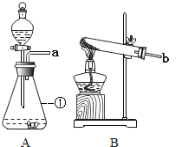
(1)装置中仪器①的名称为_____。
(2)若小明选择装置B制取氧气,则相关的文字表达式式为_____;
若用装置F收集氧气,则观察到_____时,开始收集氧气。实验结束时,应先___,后_____,目的是____。
(3)若以加热高锰酸钾的方法制取氧气,则应需将装置B进行如何改进_____
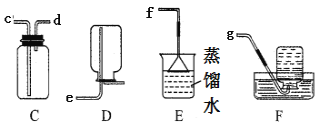
(4)用图C装置来收集氧气,气体应从____(填“c”或“d”)端通入;若瓶中装满水,则气体应从_____(填“c”或“d”)端通入。
(5)通常情况下,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶于水,密度比空气小。实验室可用浓氨水和生石灰固体常温反应制得,则制取并收集氨气装置的接口连接顺序为_____→f。上述实验中,E装置的作用是_____。
(6)探究带火星的木条在不同体积分数氧气中的复燃情况,部分实验数据记录如表:
氧气体积分数(%) | 30 | 40 | 60 | 70 |
带火星的木条 | 不变 | 稍亮 | 复燃 | 复燃 |
在集气瓶中注入占其容器50%的水(如图所示),用排水法收集氧气,将瓶内的水排尽,用带火星的木条在该集气瓶中进行实验,推测实验现象为_______。
【题目】为了测定实验室中氯酸钾样品的纯度,某学习小组取2.5g该样品与0.5g二氧化锰混合,加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体的质量,重复以上操作,依次称得加热t1、t2、 t3、t4时间后剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.48 | 2.34 | 2.04 | 2.04 |
请仔细分析实验数据,回答下列问题
(1)完全反应后产生氧气___________g
(2)该样品中氯酸钾的质量分数_________。
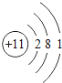
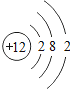
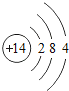
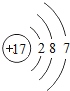
【题目】核电荷数为1﹣18的原子结构示意图等信息如下,请回答下列问题:
第一周期 | 1H
| 2He
| ||||||
第二周期 | 3Li
| 4Be
| 5B
| 6C
| 7N
| 8O
| 9F
| 10Ne
|
第三周期 | 11Na
| 12Mg
| 13Al
| 14Si
| 15P
| 16S
| 17Cl
| 18Ar
|
(1)不同种元素最本质的区别是_____(选填序号)
A质子数不同 B最外层电子数不同 C中子数不同 D相对原子质量不同
(2)在第三周期中,各原子结构的共同之处是_____;该周期中,各原子核外电子排布的变化规律是________.
(3)氧元素应位于元素周期表中第_______族.氧元素与地壳中含量最多的金属元素组成的物质的化学符号为_______。