��Ŀ����
����Ŀ����ͼΪʵ���ҳ��õ�ʵ��װ��
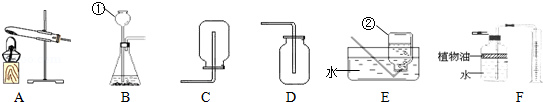
�ݴ˻ش��������⣺
��1��д����������������ƣ��� �� ��
��2�������£��ù���������Һ��Ӧ��ȡ������Ӧѡ�õķ���װ���� ������ţ���ͬ�����ռ�װ���� ����Ӧ�Ļ�ѧ����ʽΪ ��
��3��ʵ����ͨ����ϡ�����ʯ��ʯ��Ӧ��ȡCO2���÷�Ӧ�Ļ�ѧ����ʽΪ �����⣬CO2Ҳ������̼�����ƣ�NaHCO3��������ȷֽ⣨����Ϊ̼���ơ�������̼��ˮ������ȡ��Ӧѡ�õķ���װ���� ��
��4��Fװ�ÿ������������ɵ�CO2����������������ˮ���Ϸ�һ��ֲ���͵�Ŀ���� ��ֲ�����Ϸ�ԭ�еĿ�����ʵ��Ľ�� ����С���û�С�������Ӱ�죮
���𰸡���1������©��������ƿ
��2��B��D��E��2H2O2![]() 2H2O+O2��
2H2O+O2��
��3��CaCO3+2HCl�TCaCl2+H2O+CO2����A
��4����ֹ������̼����ˮ��û�У�
����������1�����dz���©�������Ǽ���ƿ��
��2�������£��ù���������Һ��Ӧ��ȡ������Ӧѡ�õķ���װ����B��
��Ϊ�������ܶȱȿ��������������ſ������ռ�������Dװ���ռ���������������ˮ����������ˮ���ռ�������Eװ���ռ�����Ӧ�Ļ�ѧ����ʽΪ��2H2O2![]() 2H2O+O2����
2H2O+O2����
��3��ʵ����ͨ����ϡ�����ʯ��ʯ��Ӧ��ȡCO2���÷�Ӧ�Ļ�ѧ����ʽΪ��CaCO3 + 2HCl �T CaCl2 + H2O + CO2��������̼��������ȡ������̼��Ҫ���ȣ�Ӧ����Aװ����Ϊ����װ�ã�
��4��Fװ�ÿ������������ɵ�CO2����������������ˮ���Ϸ�һ��ֲ���͵�Ŀ���Ƿ�ֹ������̼����ˮ����Ϊ�ж�������Ķ�����̼����ʢ��ˮ��ֲ���͵��Լ�ƿ��ʱ���ͻ��ж��������ˮ�ų��Լ�ƿ������Ͳ�У����ֲ�����Ϸ�ԭ�еĿ����Բ������������Ӱ�죮

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij��ȤС��Ϊ����֤�����غ㶨�ɣ�����þ���ڿ�����ȼ�յ�ʵ�飮
��1����д��þ����������Ӧ�Ļ�ѧ����ʽ ��
��2��С�ط���ȼ�ղ�����������ڷ�Ӧ��þ������������Ϊ�����Ӧ�����������غ㶨�ɣ��� ���ͬ�⡱��ͬ�⡱��С�صĹ۵㣬��Ϊ ��
��3��С��ͬѧ����ͼ��ʾ��װ�øĽ�ʵ�飬��֤�������غ㶨�ɣ�ȴ���ֲ����л�����������ɫ���壮
[�������]����ɫ������ʲô��
�� �� | MgO | MgCl2 | Mg3N2 | Mg��NO3��2 | MgCO3 | Mg��OH��2 |
�� ɫ | ��ɫ | ��ɫ | ����ɫ | ��ɫ | ��ɫ | ��ɫ |
[��������]С��ͬѧ�������ϣ���¼�����м��ֺ���þԪ�ص����ʵ���ɫ��
����ͬѧ��Ϊ���ز����Ȼ�þ����ɫ�������� ��
[�������]�������ϣ�������ɫ�жϣ�������Ϊ�õ���ɫ����Ӧ���� ����������þ������е� ���� ��Ӧ���ɵģ���Ӧ�Ļ�ѧ����ʽΪ ��
[ʵ��̽��]С�����ʵ��֤ʵ���Լ��IJ��룬���ķ������� ��
[��˼������]ͨ������ʵ�飬���ǿ��Է���ȼ�ղ�һ����Ҫ������
[��ؽ���]�����е�����N2����������O2���������ԼΪ ����þ���ڿ�����ȼ��ֻ���������ĵ���ɫ���壬�ɴ˵ó���һ�������� ��

