题目内容
不纯的锌6g(含杂质金属M)和不纯的铁6g(含杂质金属N),当他们分别与足量的稀硫酸反应时,最终得到氢气都是0.2g,则M、N可能是( )A.Mg、Cu
B.Fe、Al
C.Al、Mg
D.Cu、Mg
【答案】分析:根据金属活动顺序镁>铝>锌>铁>氢>铜,铜不能与酸反应放出氢气;若金属中混有铜,则产生氢气量会偏小;
金属与酸完全反应放出氢气的质量可利用经验推导公式“氢气质量= ”求得;
”求得;
使用以上方法,对金属中杂质M、N进行推断.
解答:解:根据金属完全反应放出氢气质量的计算公式:氢气质量=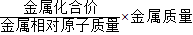
6g锌完全反应放出氢气的质量= ≈0.18g<0.2g,则该锌粉中的M应该是能与酸反应放出氢气的金属,且同等质量的金属甲完全反应产生氢气质量大于锌;而D选项中铜不能与酸反应产生氢气,故D不正确;而等质量的铁、镁、铝与酸完全反应放出氢气的质量都比锌大,因此,A、B、C选项都有可能是正确的;
≈0.18g<0.2g,则该锌粉中的M应该是能与酸反应放出氢气的金属,且同等质量的金属甲完全反应产生氢气质量大于锌;而D选项中铜不能与酸反应产生氢气,故D不正确;而等质量的铁、镁、铝与酸完全反应放出氢气的质量都比锌大,因此,A、B、C选项都有可能是正确的;
6g铁与酸完全反应放出氢气的质量= ≈0.21g>0.2g,则铁粉中金属N不能与酸反应或虽是能与酸反应放出氢气但等质量的金属N完全反应放出氢气的质量小于铁;而选项B中等质量的铝完全反应放出氢气的质量大于铁,故B选项不正确;选项C中的N的镁能与酸反应,铁粉中混有镁时放出氢气的质量偏大,故C选项不正确;
≈0.21g>0.2g,则铁粉中金属N不能与酸反应或虽是能与酸反应放出氢气但等质量的金属N完全反应放出氢气的质量小于铁;而选项B中等质量的铝完全反应放出氢气的质量大于铁,故B选项不正确;选项C中的N的镁能与酸反应,铁粉中混有镁时放出氢气的质量偏大,故C选项不正确;
故选A.
点评:等质量的金属镁、铝、锌、铁与足量酸完全反应产生氢气由多到少的顺序为铝>镁>铁>锌,根据这一关系结合极端假设的方法可方便快速地进行判断.
金属与酸完全反应放出氢气的质量可利用经验推导公式“氢气质量=
 ”求得;
”求得;使用以上方法,对金属中杂质M、N进行推断.
解答:解:根据金属完全反应放出氢气质量的计算公式:氢气质量=
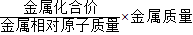
6g锌完全反应放出氢气的质量=
 ≈0.18g<0.2g,则该锌粉中的M应该是能与酸反应放出氢气的金属,且同等质量的金属甲完全反应产生氢气质量大于锌;而D选项中铜不能与酸反应产生氢气,故D不正确;而等质量的铁、镁、铝与酸完全反应放出氢气的质量都比锌大,因此,A、B、C选项都有可能是正确的;
≈0.18g<0.2g,则该锌粉中的M应该是能与酸反应放出氢气的金属,且同等质量的金属甲完全反应产生氢气质量大于锌;而D选项中铜不能与酸反应产生氢气,故D不正确;而等质量的铁、镁、铝与酸完全反应放出氢气的质量都比锌大,因此,A、B、C选项都有可能是正确的;6g铁与酸完全反应放出氢气的质量=
 ≈0.21g>0.2g,则铁粉中金属N不能与酸反应或虽是能与酸反应放出氢气但等质量的金属N完全反应放出氢气的质量小于铁;而选项B中等质量的铝完全反应放出氢气的质量大于铁,故B选项不正确;选项C中的N的镁能与酸反应,铁粉中混有镁时放出氢气的质量偏大,故C选项不正确;
≈0.21g>0.2g,则铁粉中金属N不能与酸反应或虽是能与酸反应放出氢气但等质量的金属N完全反应放出氢气的质量小于铁;而选项B中等质量的铝完全反应放出氢气的质量大于铁,故B选项不正确;选项C中的N的镁能与酸反应,铁粉中混有镁时放出氢气的质量偏大,故C选项不正确;故选A.
点评:等质量的金属镁、铝、锌、铁与足量酸完全反应产生氢气由多到少的顺序为铝>镁>铁>锌,根据这一关系结合极端假设的方法可方便快速地进行判断.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
不纯的锌6g(含杂质金属M)和不纯的铁6g(含杂质金属N),当他们分别与足量的稀硫酸反应时,最终得到氢气都是0.2g,则M、N可能是( )
| A、Mg、Cu | B、Fe、Al | C、Al、Mg | D、Cu、Mg |