题目内容
在50g质量分数为5%的NaCl溶液,若将其溶质的质量分数增大一倍,应采用的方法是( )
| A、把溶剂蒸发掉一半 |
| B、加入2.5g NaCl |
| C、把溶剂蒸发掉25g |
| D、加入50g质量分数为5%的NaCl溶液 |
考点:有关溶质质量分数的简单计算
专题:溶液的组成及溶质质量分数的计算
分析:要使溶液的溶质质量分数变大,常通过两种方式:①加入溶质,②蒸发溶剂,据此结合溶质质量分数的计算进行分析判断.
解答:解:50g质量分数为5%的NaCl溶液的质量为50g×5%=2.5g,含溶剂50g-2.5g=47.5g.
A、设需要蒸发水的质量为x,(50g-x)×10%=2.5g,x=25g,应将溶剂蒸发掉溶液质量的一半,而不是溶剂质量的一半,故选项采用的方法错误.
B、设需要再溶解NaCl的质量为y,(50g+y)×10%=2.5g+y,y=9.375g,故选项采用的方法错误.
C、根据A选项的分析,需要蒸发水的质量为25g,故选项采用的方法正确.
D、加入50g质量分数为5%的NaCl溶液,由于和原溶液的溶质质量分数相同,故混合后溶质质量分数仍为5%,故选项采用的方法错误.
故选:C.
A、设需要蒸发水的质量为x,(50g-x)×10%=2.5g,x=25g,应将溶剂蒸发掉溶液质量的一半,而不是溶剂质量的一半,故选项采用的方法错误.
B、设需要再溶解NaCl的质量为y,(50g+y)×10%=2.5g+y,y=9.375g,故选项采用的方法错误.
C、根据A选项的分析,需要蒸发水的质量为25g,故选项采用的方法正确.
D、加入50g质量分数为5%的NaCl溶液,由于和原溶液的溶质质量分数相同,故混合后溶质质量分数仍为5%,故选项采用的方法错误.
故选:C.
点评:本题难度不是很大,考查溶液的浓缩问题,掌握溶液浓缩的方法、原理是正确解答此类题的关键所在.

练习册系列答案
相关题目
下列物质的区分方法正确的是( )
| A、硬水和软水--肥皂水 |
| B、葡萄糖和面粉--灼烧 |
| C、实验室中的蔗糖水和食盐水--尝味道 |
| D、氮气与二氧化碳--燃着的木条 |
某学生用量筒量取液体时,量筒放平稳且面对刻度线.读数时仰视线读数为28.2mL,倒出部分液体后,俯视读数为12.2mL.该学生实际倒出的液体的体积是( )
| A、等于16mL |
| B、大于16mL |
| C、小于16mL |
| D、无法确定 |
下列关于过氧化氢的叙述正确的是( )
| A、过氧化氢的组成、结构与水相同 |
| B、过氧化氢是一个氢分子和一个氧分子组成 |
| C、过氧化氢这种物质由两个氢原子和两个氧原子构成 |
| D、过氧化氢由氢元素和氧元素组成 |
下列化学用语与含义相符的是( )
| A、2O--2个氧元素 |
| B、H2O--水 |
| C、H2--2个氢原子 |
| D、Ca+2--钙离子 |
能一次性将白色固体CaCO3、NaCl、CaO、CuSO4、NH4NO3区别出来的试剂( )
| A、紫色石蕊试液 | B、碳酸钠 |
| C、盐酸 | D、水 |
下列有关CO2的实验中,只能证明CO2物理性质的是( )
A、 |
B、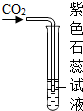 |
C、 |
D、 |
下列化学方程式书写正确的是( )
A、C+O2
| ||||
B、H2O2
| ||||
| C、2H2O═2H2↑+O2↑ | ||||
D、4P+5O2
|