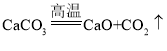题目内容
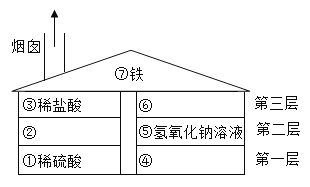
【题目】某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计如图实验方案:
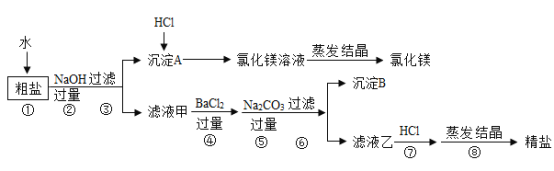
请回答下列问题:
(1)步骤①溶解过程中用玻璃棒搅拌的目的是_____。
(2)步骤④⑤的顺序颠倒会引发的后果是_____。
(3)滤液乙中所含的溶质除氯化钠外还含有_____。
(4)在步骤⑦中若加入的盐酸略过量对实验结果没有影响,其原因是_____。
【答案】加速溶解 精盐中会混有氯化钡 碳酸钠和氢氧化钠 因为蒸发时氯化氢气体挥发掉
【解析】
操作步骤顺序:
1、将粗盐溶于足量水中制成溶液
2、向溶液中加入足量NaOH溶液,除去Mg2+,反应的方程式为:2NaOH+MgCl2=2NaCl+Mg(OH)2↓,过滤,除去滤渣
3、向上述溶液中加入足量的BaCl2溶液,除去SO42-,反应方程式为:Na2SO4+BaCl2=2NaCl+BaSO4↓
4、向上述溶液中加入足量的Na2CO3溶液,除去Ca2+、Ba2+,反应方程式为:Na2CO3+CaCl2=2NaCl+CaCO3↓、Na2CO3+BaCl2=2NaCl+BaCO3↓
5、过滤后向上述滤液中滴加稀盐酸,调节pH=7,除去CO32-和OH-,反应方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaOH+HCl=NaCl+H2O
6、将氯化钠溶液蒸发、洗涤干燥,即可得到较纯净的食盐
(1)在溶解的过程中使用玻璃棒搅拌的目的是加速溶解的速率。故答案为:加速溶解;
(2)氯化钡可以除去杂质离子SO42-,碳酸钠可以除去杂质离子Ca2+和之前加入的过量的Ba2+。加入的碳酸钠溶液应该放在氯化钡溶液之后,否则多余的钡离子无法除去。故答案为:精盐中会混有氯化钡;
(3)根据上述除杂过程可知,滤液乙中的溶质除了氯化钠,还有碳酸钠和氢氧化钠。故答案为:碳酸钠和氢氧化钠;
(4)由于盐酸具有挥发性,在蒸发操作时,氯化氢气体会挥发掉,所以加入的盐酸略过量不会影响实验结果。故答案为:因为蒸发时氯化氢气体挥发掉。