题目内容
 如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:
如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:
(1)欲配制14.6%的稀盐酸100g,需要这种盐酸多少克?______(2)用上述配得的稀盐酸与足量的锌充分反应,可制得氢气多少克?______.
解:(1)需要标签注明质量分数为20%的盐酸的质量= =73g;
=73g;
(2)设可制得氢气质量为x
Zn+2HCl═ZnCl2+H2↑
73 2
100g×14.6% x
 =
=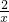 x=0.4g
x=0.4g
故答案为:(1)73g;(2)0.4g.
分析:(1)根据加水稀释前后溶液中溶质质量相等,由标签查得盐酸的溶质质量分数为20%,然后由稀释前后溶质质量相等的关系,计算需要这种盐酸的质量;
(2)锌与盐酸反应生成氯化锌和氢气,根据反应的化学方程式,由消耗HCl的质量计算制得氢气的质量.
点评:加水稀释时,稀释前溶液的质量×溶液的溶质质量分数=稀释后溶液质量×溶液的溶质质量分数.
 =73g;
=73g;(2)设可制得氢气质量为x
Zn+2HCl═ZnCl2+H2↑
73 2
100g×14.6% x
 =
=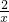 x=0.4g
x=0.4g故答案为:(1)73g;(2)0.4g.
分析:(1)根据加水稀释前后溶液中溶质质量相等,由标签查得盐酸的溶质质量分数为20%,然后由稀释前后溶质质量相等的关系,计算需要这种盐酸的质量;
(2)锌与盐酸反应生成氯化锌和氢气,根据反应的化学方程式,由消耗HCl的质量计算制得氢气的质量.
点评:加水稀释时,稀释前溶液的质量×溶液的溶质质量分数=稀释后溶液质量×溶液的溶质质量分数.

练习册系列答案
相关题目
 如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算,欲配制14.6%的稀盐酸100g,需要这种盐酸的质量为( )
如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算,欲配制14.6%的稀盐酸100g,需要这种盐酸的质量为( )| A、73g | B、66g | C、34g | D、27g |
 如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:
如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算: