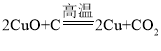题目内容
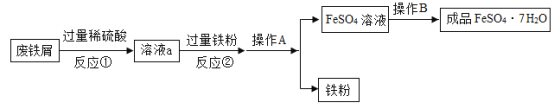
【题目】高铁酸钾(K2FeO4)是一种具有氧化、吸附、凝聚、杀菌等功能的新型、高效水处理剂。在水体净化的过程中不产生任何有毒、有害的物质,具有广阔的研究开发前景。如图所示是以铁屑为原料制备K2FeO4的工艺流程图:
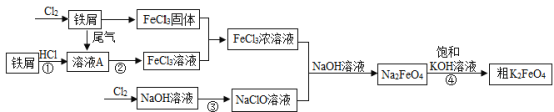
(1)溶液A中溶质的化学式为_____________________。
(2)写出步骤②发生反应的化学方程式_____________________。
(3)向氢氧化钠溶液中通入氯气,二者反应生成NaClO和一种厨房常用调味品以及一种由两种元素组成,质量比为1:8的物质,该反应的化学方程式为_____________________。
(4)步骤④发生的是复分解反应,说明Na2FeO4的溶解度比K2FeO4的溶解度_____________________(填“大”或“小”)。
【答案】FeCl2 ![]()
![]() 大
大
【解析】
步骤①为铁屑与稀盐酸的反应,该反应生成溶液A(氯化亚铁溶液);步骤②为溶液A(氯化亚铁)和尾气反应生成氯化铁,根据质量守恒定律可知,该尾气应为氯气;题中给出的是氯气与氢氧化钠发生的反应,根据质量守恒定律可知,反应物中只含有H、O、Na、Cl四种元素,根据所给信息即可判断生成物的化学式。
(1)溶液A为铁屑与稀盐酸反应生成的氯化亚铁溶液;
(2)尾气为氯气,氯气与氯化亚铁反应生成氯化铁,化学方程式:![]() ;
;
(3)由化学反应前后元素种类不变,可知氯气与氢氧化钠溶液反应生成次氯酸钠、氯化钠和水,其中氯化钠是厨房常用的调味品,水中氢、氧元素的质量比1:8,反应方程式:![]() 。
。
(4)复分解反应发生的条件是有气体或水或沉淀生成,由此可知Na2FeO4的溶解度大于K2FeO4的溶解度。

 口算题天天练系列答案
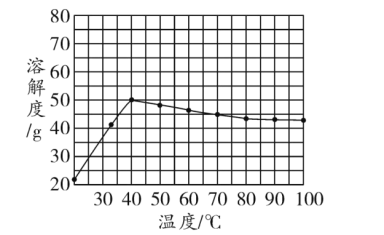
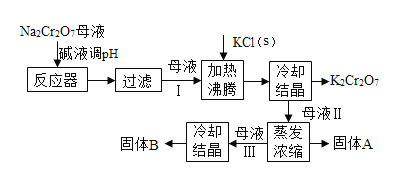
口算题天天练系列答案【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),其生产流程和相关物质的溶解度曲线及溶解度数据如图(假设流程中反应恰好完全进行):
物质 | 溶解度(g/100g H2O) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
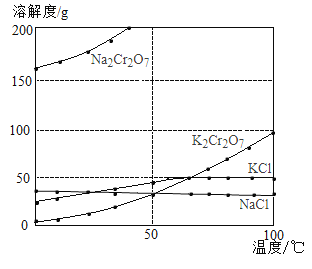
(1)由溶解度曲线可知,50℃时,K2Cr2O7、KCl、NaCl三种物质溶解度的大小关系为_____________,100℃时,用等质量的K2Cr2O7、KCl、NaCl三种固体配制成饱和溶液,溶液质量大小关系为_____________。
(2)将40℃四种物质的饱和溶液降温至0℃,溶质质量分数最小的是______________。
(3)加碱液调节pH的目的是____________。
(4)加入氯化钾固体后,反应的化学方程式为___________。根据溶解度数据可知,该反应能够发生的原因是____________。
(5)流程中要得到母液Ⅲ和固体A的操作为___________,蒸发浓缩原因是___________。