题目内容
【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
一、为探究催化剂的种类对双氧水分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0g 10%过氧化氢溶液与1.0g MnO2均匀混合;Ⅱ.将x g10% H2O2溶液与1.0g CuO均匀混合。在相同温度下,比较两组实验产生O2的快慢。
(1)为了Ⅰ与Ⅱ中对比x的值应为 。
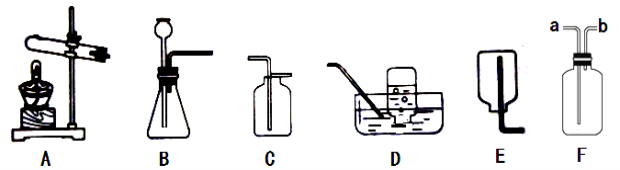
(2)甲选用下列装置测量产生O2的快慢,正确的是 (填编号)。

二、探究影响双氧水分解速度的某种因素。实验数据记录如下(常温通常指20℃)
实验 | 温度 | 药品 | 氧气体积/ml | 反应所需时间/s | |
① | 常 温 | 5% H2O2 | 0 | ||
常 温 | 5% H2O2 | MnO2 | 125 | 20 | |
② | 常 温 | 5% H2O2 | MnO2 | 125 | 20 |
热水中 | 5% H2O2 | MnO2 | 125 | 18 | |
③ | 常 温 | 5% H2O2 | MnO2 | 125 | 20 |
常 温 | 30% H2O2 | MnO2 | 125 | 5 | |
(1)通过实验①对比可知,化学反应快慢与 有关。
(2)通过对比实验 可知,反应物浓度大,反应速率快。
(3)除了上述两个因素能影响化学反应快慢,你认为另一个影响因素是 ,其关系是 。
(4)由上述实验可知温度、浓度、催化剂等都是影响化学反应速率,实验室用过氧化氢制取氧气的最合适的条件是 。
【答案】一、Ⅰ.(1)3.0g。(2)B(填编号)。
二、(1)、催化剂 (2),(3)温度 温度高反应速率快。
(4)常温下,用5%的过氧化氢溶液加二氧化锰作催化剂制氧气。
【解析】
试题分析:一、Ⅰ.(1)需控制变量,即只有催化剂种类不同这一变量,过氧化氢溶液的质量需一致,为3.0g。(2)即通过收集氧气排出水,通过水的排出速度来测得氧气的生成速度,选B。
二、(1)、变量为有无二氧化锰,因此催化剂影响反应快慢。(2)③中变量为反应物浓度;(3)由②可得温度,且温度高反应速率快;(4)加热会增加操作难度且易引发安全问题,因此需常温下,又加快反应速率需加二氧化锰作催化剂。