题目内容
(2005?河南)将等质量的镁、锌、铁三种金属分别与相等质量、相等质量分数的盐酸反应,其中只有镁与盐酸恰好完全反应,这三种金属中产生氢气质量最小的是.
【答案】分析:利用一定质量金属完全反应所放出氢气的质量=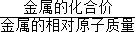 ×金属的质量,可知等质量的镁、锌、铁三种金属分别盐酸反应时,生成的氢气的质量顺序是:镁>铁>锌,镁能恰好反应说明铁与锌都能完全反应,则可知锌生成的氢气最少.
×金属的质量,可知等质量的镁、锌、铁三种金属分别盐酸反应时,生成的氢气的质量顺序是:镁>铁>锌,镁能恰好反应说明铁与锌都能完全反应,则可知锌生成的氢气最少.
解答:解:当金属与酸反应制取氢气时,有如下的公式:氢气的质量=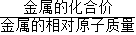 ×金属的质量;因此可知等质量的镁、锌、铁三种金属分别盐酸反应时,生成的氢气的质量顺序是:镁>铁>锌,在题目叙述的过程中镁恰好反应,则锌铁都能完全反应且酸有剩余,因为氢气是由酸得到的,所以生成氢气量最小的是锌.
×金属的质量;因此可知等质量的镁、锌、铁三种金属分别盐酸反应时,生成的氢气的质量顺序是:镁>铁>锌,在题目叙述的过程中镁恰好反应,则锌铁都能完全反应且酸有剩余,因为氢气是由酸得到的,所以生成氢气量最小的是锌.
故答案为:锌
点评:根据一定质量金属完全反应所放出氢气的质量=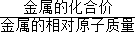 ×金属的质量,可对此类问题大大简化,从而起到事半功倍的效果.
×金属的质量,可对此类问题大大简化,从而起到事半功倍的效果.
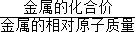 ×金属的质量,可知等质量的镁、锌、铁三种金属分别盐酸反应时,生成的氢气的质量顺序是:镁>铁>锌,镁能恰好反应说明铁与锌都能完全反应,则可知锌生成的氢气最少.
×金属的质量,可知等质量的镁、锌、铁三种金属分别盐酸反应时,生成的氢气的质量顺序是:镁>铁>锌,镁能恰好反应说明铁与锌都能完全反应,则可知锌生成的氢气最少.解答:解:当金属与酸反应制取氢气时,有如下的公式:氢气的质量=
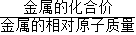 ×金属的质量;因此可知等质量的镁、锌、铁三种金属分别盐酸反应时,生成的氢气的质量顺序是:镁>铁>锌,在题目叙述的过程中镁恰好反应,则锌铁都能完全反应且酸有剩余,因为氢气是由酸得到的,所以生成氢气量最小的是锌.
×金属的质量;因此可知等质量的镁、锌、铁三种金属分别盐酸反应时,生成的氢气的质量顺序是:镁>铁>锌,在题目叙述的过程中镁恰好反应,则锌铁都能完全反应且酸有剩余,因为氢气是由酸得到的,所以生成氢气量最小的是锌.故答案为:锌
点评:根据一定质量金属完全反应所放出氢气的质量=
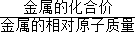 ×金属的质量,可对此类问题大大简化,从而起到事半功倍的效果.
×金属的质量,可对此类问题大大简化,从而起到事半功倍的效果. 
练习册系列答案
相关题目
 溶液时,反应速率较慢,若向其中加入
溶液时,反应速率较慢,若向其中加入 ,则能较快的产生氧气.这一现象说明什么?
,则能较快的产生氧气.这一现象说明什么?
 反应较慢,加热时反应速率明显加快.这一现象说明什么?
反应较慢,加热时反应速率明显加快.这一现象说明什么?