题目内容
【题目】某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,实验测得相关数据如下图所示:
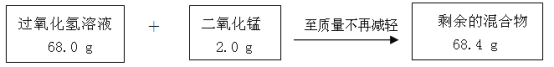
(1)剩余的混合物中二氧化锰的质量为 g,反应生成氧气的质量为 g。
(2)计算该过氧化氢溶液中溶质质量分数。
(3)实验表明硫酸铜溶液在该反应中也能起到二氧化锰的作用。若用5.6g无水硫酸铜代替二氧化锰进行本实验,计算剩余的溶液中溶质的质量分数。
(硫酸铜全部溶于水,计算时保留到0.1%)
【答案】(1)2.0, 1.6 (2)5.0% (3) 7.8%
【解析】(1) 反应中催化剂二氧化锰在反应前后质量不变,仍为1.0g;根据质量守恒定律,反应生成氧气的质量=68.0g+1.0g-67.4g=1.6g;
(2)设68.0 g过氧化氢溶液中含有过氧化氢的质量为x。
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g
68:32 = x : 1.6g 解得 x = 3.4g
过氧化氢溶液的溶质的质量分数= 3.4g/68.0g ×100% = 5.0%
(3)硫酸铜溶液的溶质质量分数= 5.6g / (68.4g— 2.0g + 5.6g) ×100% ≈ 7.8%

【题目】为探究酒精灯火焰不同部住的加热效果,李明同学取来3支试管,分别编号为A、B、C.向试管内各加入 3mL 水,进行了如下实验:
(1)把A试管底部放在酒精灯火焰上方约3cm处加热;
(2)把B试管底部放在酒精灯外焰部分加热;
(3)把C试管底部放在酒精灯灯芯处加热.实验结果如下表:
试管编号 | A | B | C |
水沸腾所用时间(S) | 90 | 30 | 45 |
你由此得出的结论是 ,根据这一结论,用酒精灯加热时应用 来加热.
【题目】空气和水是人类赖以生存的自然资源。
(本题涉及到的物质均用化学式填写):
(1)氮气、氧气、氦气和二氧化碳都是空气的成分。
图中a代表的气体是_____;引起温室效应的是_____;通电时发出有色光的是_____;供给呼吸的是_____。
(2)空气中主要组分的沸点如下表:
组分 | 氮气 | 氧气 | 二氧化碳 |
沸点(℃) | -195.8 | -183.0 | -78.5 |
空气是工业上制取大量氧气的原料,工业制氧气属于_____变化(填“物理”或“化学”)。将液态空气升温至-195℃,收集逸出的物质,此时逸出的物质主要是____;继续升温至-183℃,逸出的物质能使带火星的木条复燃,此时逸出的物质主要是_____。