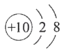题目内容
丙酸钠是一种常用的食品添加剂,其化学式为C3H5OxNa。已知该化合物中碳元素与氧元素的质量比为9∶8,请计算:
(1)丙酸钠由____________种元素组成;
(2)X=_____________________;
(3)该物质的相对分子质量是______________。
兴趣小组在课外实验中意外发现:将镁条放入Na2CO3溶液中,快速产生较多气泡,有白色沉淀生成。小组同学对此进行了系列探究活动。
探究Ⅰ:反应产生的气体是什么?
(作出猜想)小组同学经查阅资料和讨论,根据化学变化过程中元素不变, 提出如下猜想:
①氢气;
②二氧化碳;
③氢气和二氧化碳。
(实验1)取5g打磨后的镁条、100 mL Na2CO3溶液于装置A中,按图1所示方案进行实验。观察到的现象是_________,说明猜想①正确。
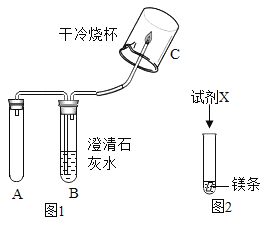
探究Ⅱ:快速产生气体的原因是什么?
(查阅资料)镁与水缓慢反应生成氢气; Na2CO3溶液显碱性,其溶液中除Na+、CO 外,还有OH-。
外,还有OH-。
(作出猜想)可能是Na2CO3溶液中的某一种离子促进了镁与水的反应。
(实验2)将等质量的镁条按照图2进行如下如下实验。
实验序号 | a | b | c |
溶液(浓度相同) | H2O | Na2CO3 | NaOH |
30min时产生气体体积(mL) | <0.2 | 0.7 | <0.2 |
气体的主要成分 | H2 | ||
30min时镁条表面情况 | 大量白色固体附着 |
(1)实验2中a组实验的作用是_______
(2)探究2中能够说明CO 对Mg与水反应起促进作用的证据是____。
对Mg与水反应起促进作用的证据是____。
探究3:反应产生的白色沉淀中是否含有MgCO3?
(实验3)利用如图装置证明样品中含有MgCO3(夹持仪器略去)。
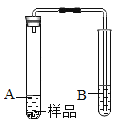
(1)所需要的试剂分别是:A___、B_____。
(2)实验中观察到的现象有___反思交流:有些伟大的发现就是从异常现象中得到启发,通过深入研究而实现的。


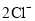 B.2个氧分子:2O
B.2个氧分子:2O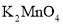 D.
D.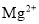 的结构示意图:
的结构示意图: