题目内容
【题目】金属在生产和生活中起重要作用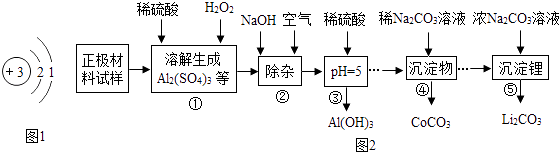
Ⅰ.金属锂在新能源开发中占有重要地位
(1)锂(Li)原子结构示意图如图1所示,Li在化学反应中容易(填“得”或“失”)电子,它的离子符号为 .
(2)LiOH和NaOH都属于碱,它们的水溶液解离出相同的(填“H+”或“OH﹣”).
(3)Ⅱ.废旧锂电池主要回收是正极材料,其主要成分为钴酸锂(LiCoO2)、铝箔等,回收工艺流程如图2:
从流程图可得:回收的产物除了有Li2CO3 , 还有(写一种).
(4)步骤③中,溶液呈(填“酸性”、“中性”或“碱性”)
(5)写出步骤①中稀硫酸溶解铝箔(Al)的化学方程式 .
【答案】
(1)失,Li+
(2)OH﹣
(3)Al(OH)3
(4)酸性
(5)2Al+3H2SO4=Al2(SO4)3+3H2↑
【解析】解:(1)锂原子最外层有1个电子,电子个数小于4在化学变化中易失去电子,而形成带1个单位正电荷的锂离子,故填:失;Li+;(2)碱是由金属阳离子或铵根离子和氢氧根离子构成的化合物,碱的水溶液中能离解出氢氧根离子,故填:OH﹣;(3)由题中流程图可以看出在整个生产过程中共生成了三种物质:氢氧化铝、碳酸钴、碳酸锂,所以除了碳酸锂外另外两种也是可回收的产生,故填:Al(OH)3或CoCO3;(4)由步骤③时溶液pH等于5可知此时溶液显酸性,故填:酸性;(5)铝和稀硫酸反应生成硫酸铝和氢气,据此书写化学方程式,故填:2Al+3H2SO4=Al2(SO4)3+3H2↑.
【考点精析】根据题目的已知条件,利用书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握注意:a、配平 b、条件 c、箭号.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目