题目内容
【题目】随着社会的发展,人们的生活越来越离不开化学。
(1)煤、石油和________常被称为化石燃料。
(2)燃煤发电时,将煤块粉碎成煤粉,其目的是________ 。
(3)木炭不充分燃烧会产生一种有毒气体,写出该反应的化学方程式________。
(4)“绿色化学”的特点之一是“零排放”。一定条件下,一氧化碳和氢气可以按照不同比例反应,只生成一种产物就能实现“零排放”,这种产物可能是________ (填字母序号,下同)。
A甲醇 B甲酸 C乙醇 D乙酸
(5)下列措施中,不利于降低大气中二氧化碳含量的是______________。
A大量使用化石燃料
B植树造林,增大植被面积
C将二氧化碳变废为宝,循环利用
【答案】天然气 增大煤与氧气的接触面积,使煤燃烧更充分 2C+O2![]() 2CO AD A
2CO AD A
【解析】
(1)煤、石油和天然气常被称为化石燃料;
(2)燃煤发电时,将煤块粉碎成煤粉,其目的是增大煤与氧气的接触面积,使煤燃烧更充分;
(3)木炭不充分燃烧生成—氧化碳,该反应的化学方程式为:2C+O2![]() 2CO;
2CO;
(4)根据“一氧化碳和氢气反应,只生成一种产物”可判断所生成的产物中C、O元素的原子个数比应与CO中C、O元素的原子个数相同为1:1。
A、甲醇化学式为CH4O,可知该物质中C、O元素的原子个数比为1:1,符合所生成产物的特点,故A正确;
B、甲酸化学式为CH2O2,可知该物质中C、O元素的原子个数比为1:2,不符合所生成产物的特点,故B错误;
C、乙醇化学式为C2H6O,可知该物质中C、O元素的原子个数比为2:1,不符合所生成产物的特点,故C错误;
D、乙酸化学式为C2H4O2,可知该物质中C、O元素的原子个数比为1:1,符合所生成产物的特点,故D正确。故选AD;
(5)A、大量使用化石燃料,化石燃料燃烧生成二氧化碳,增加二氧化碳含量;
B、植树造林,增大植被面积,光合作用可把二氧化碳气体转变为氧气,消耗二氧化碳;
C.将二氧化碳变废为宝,循环利用,大量利用二氧化碳,降低二氧化碳含量;故选A。

【题目】某校学生用下如图的实验验证质量守恒定律。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的白光,产生大量白烟弥漫到空气中,最后一些白色固体掉落在石棉网上。
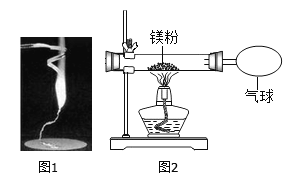
(1)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。你认为出现该实验结果的原因可能是________。
(2)小红按如图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁固体;③氮化镁可与水剧烈反应产生氨气,氨气有强烈的刺激性气味。
(做出猜想)黄色固体是Mg3N2。
(实验探究)请设计实验,验证猜想
实验操作 | 实验现象 | 结论 |
________ | ________ | 黄色固体是Mg3N2 |
(3)(反思与交流)
①氮化镁中氮元素的化合价是_________;
②写出镁条燃烧生成氮化镁的化学方程式________;
③空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是 ________;
④从镁条能在氮气中燃烧、钠能在氯气中燃烧的实验事实,你对燃烧条件有了什么新的认识?请写出一种:________。