题目内容
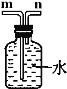
【题目】现有碳酸钙、氯化钙组成的混合物样品。小军想计算混合物中各成分的质量,进行了如下图所示的实验:

请回答。下列问题:
(1)写出发生反应的化学方程式____________________________;
(2)列出求解生成沉淀质量x的比例式______________________;
(3)混合物样品中各成分的质量比为____________________;
(4)在加入碳酸钠溶液的过程中,烧杯中溶质质量的变化情况为_____________________;
(5)若最终所得的不饱和溶液B的溶质的质量分数为5%,则加入水的质量为__________。
【答案】(1)CaCl2+Na2CO3==CaCO3↓+2NaCl
(2)106/100=10.6g/x (3 )111:50
(4)氯化钙的质量逐渐减少至消失,氯化钠的质量逐渐增多(5)32.9g
【解析】
试题分析:(1)氯化钙与碳酸钠反应生成的是碳酸钙沉淀和氯化钠:CaCl2+Na2CO3==CaCO3↓+2NaCl;
(2)利用化学方程式,根据反应的质量比即可计算出生成的碳酸钙沉淀的质量。
加入的碳酸钠溶液中溶质碳酸钠的质量=100g×10.6%=10.6g
设生成的碳酸钙的质量为x,设氯化钙的质量为y,生成的氯化钠的质量为z,
CaCl2+Na2CO3==CaCO3↓+2NaCl
111 106 100 117
y 10.6g x z
106/100=10.6g/x
X=10g
(3)106/111=10.6g/y,y=11.1g
混合物中碳酸钙的质量=16.1g-11.1g=5g,
氯化钙与碳酸钙的质量比=11.1:5=111:50;
(4)氯化钙与碳酸钠反应生成的是碳酸钙沉淀和氯化钠,故氯化钙的质量逐渐减少至消失,氯化钠的质量逐渐增多;
(5)反应后溶液中溶质的质量为氯化钠,生成的氯化钠的质量为:
106/117=10.6g/z,z=11.7g
反应后溶液的质量=16.1g+100g+100g-15g=201.1g
溶液稀释前后溶质的质量不变,设稀释后溶液的质量为a,那么:
5%a=11.7g ,a=234g
加入水的质量=234g-201.1g=32.9g

 计算高手系列答案
计算高手系列答案