题目内容
【题目】海水中含有大量的NaCl,可用于制备钠及其化合物,其流程如下图:
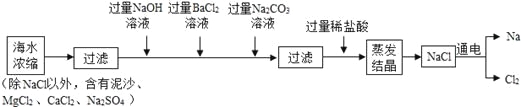
(1)过滤是将难溶性固体与 分离的一中实验操作。在上述蒸发结晶的过程中发生了 变化。
(2)加入过量Na2CO3溶液目的是除去CaCl2和 ,流程中不能用过量稀硫酸代替过量稀盐酸的原因是 ,请写出Na2CO3与CaCl2反应的化学方程式 。
(3)我国古代湿法炼铜是将铁放入硫酸铜溶液中,请用化学方程式表示 。
依据炼铜与炼钠的反应条件不同,判断金属钠比铜获得 (填“更早”或“更晚”)。
【答案】(1)液体;物理变化(2)氯化钡;防止产生新的杂质;CaCl2+Na2CO3===2NaCl+CaCO3↓(3)Fe+CuSO4==FeSO4+Cu;更晚
【解析】试题分析:过滤是将难溶性固体与液体分离的一中实验操作。在上述蒸发结晶的过程中发生了物理变化。加入过量Na2CO3溶液目的是除去CaCl2和过量的氯化钡,流程中不能用过量稀硫酸代替过量稀盐酸的原因是因为会产生新的杂质硫酸钠,请写出Na2CO3与CaCl2反应的化学方程式CaCl2 +Na2CO3=2NaCl+CaCO3↓。我国古代湿法炼铜是将铁放入硫酸铜溶液中,化学方程式表示Fe+CuSO4==FeSO4+Cu。依据炼铜与炼钠的反应条件不同,判断金属钠比铜获得更晚,因为金属的活动性越强,越难被炼制。

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
【题目】分析下面实验内容和结论,正确的一组是
实验内容 | 实验结论 | |
A | 带有火星的木条置于氧气瓶中,木条复燃 | 氧气有可燃性 |
B | 二氧化碳气体通入紫色石蕊试液中,石蕊试液变红色 | 二氧化碳有酸性 |
C | 稀盐酸滴入氢氧化钠溶液中,未观察到明显现象 | 二者没有发生化学反应 |
D | 氯化钙溶液滴入某溶液中,出现白色沉淀 | 溶液中可能含有CO32﹣ |